A primeira tentativa conhecida para aliviar uma estenose aórtica ocorreu em 1913, na França, realizada por Tuffier[1], com a dilatação digital da válvula por meio da invaginação da parede da aorta ascendente. Anos depois, em 1947, Horace Smith conduziu procedimentos de valvulotomia e valvulectomia parcial da válvula aórtica em cães normais. Pouco tempo depois, em 1960, a introdução da válvula de bola de Starr-Edwards marcou o maior avanço no tratamento cirúrgico das doenças das valvas cardíacas, sendo amplamente utilizada, embora a mortalidade dos pacientes por vezes alcançasse índices de 10 a 20% por sua trombogenicidade e fatores funcionais adversos[2].
A substituição da valva aórtica tem como objetivo restaurar as condições hemodinâmicas ideais e proporcionar alívio dos sintomas do paciente. Atualmente, mais de meio século após as primeiras tentativas de abordar os refluxos valvares, muitas dúvidas relacionadas ao tratamento cirúrgico das lesões das valvas cardíacas foram resolvidas. Contudo, persistem algumas incertezas quando, já no intraoperatório, observa-se que a implantação de uma prótese valvar com tamanho apropriado é dificultada pela existência de um anel aórtico ou aorta ascendente hipoplásicos[3]. Com o objetivo de minimizar a probabilidade do desenvolvimento tardio de obstrução na via de saída do ventrículo esquerdo e aumentos inapropriados de gradientes transvalvares durante a substituição valvar aórtica, várias técnicas de ampliação do anel aórtico (AAA) foram desenvolvidas.
A origem da via de saída do ventrículo esquerdo se dá na raiz da aorta, começando nas bases das válvulas semilunares e estendendo-se até a junção sinotubular, marcando a transição para a aorta ascendente (Figura 1). O estudo sobre sinvastatina e ezetimiba em pacientes com estenose aórtica (SEAS trial) em análise secundária identificaram que pacientes com tamanho da raiz da aorta indexado para superfície corpórea menor que 14 mm/m para mulheres e 15 mm/m para homens tinham correlação com anel aórtico de tamanho médio de 21,3 mm. Universalmente é aceita como definição de anel aórtico pequeno aqueles em que não é possível acoplar uma prótese de tamanho maior que 21 mm[4,5]. Todos esses componentes são expostos à dinâmica ventricular e em todas as válvulas ocorre um gradiente pressórico transvalvular que está inversamente relacionado ao fluxo sanguíneo através do óstio valvular, seguindo os princípios físicos da equação de continuidade (considerando área transeccional da via de saída do ventrículo esquerdo multiplicada pela velocidade do sangue que passa nessa região, deve ser igual à área transeccional da valva aórtica multiplicada pela velocidade de sangue nessa região; logo, situações de estenose aórtica levam a um aumento na velocidade do fluxo sanguíneo pela valva aórtica e aumento do gradiente transvalvar)[3,6]. Esse gradiente pressórico depende do tamanho, tipo e modelo da válvula, e a fibrose que se desenvolve nos anéis valvulares também contribui para a estenose do óstio em próteses e válvulas biológicas, resultando no aumento dos gradientes pressóricos transvalvulares[2]. Quando a área efetiva do orifício (AEO) da prótese implantada é consideravelmente menor em comparação à área de superfície corporal (ASC) do paciente, o resultado simula uma estenose aórtica e é o que chamamos de desproporção prótese-paciente (DPP). Nesse quadro, a presença desses gradientes hemodinâmicos elevados está associada a um aumento na mortalidade a curto prazo por diversas causas e a longo prazo por motivos cardiovasculares, mesmo quando a prótese está funcionando corretamente[7].
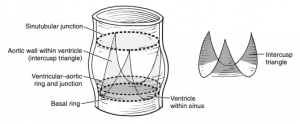
Figura 1. Delimitação da raiz aórtica, evidenciando o nível do chamado “anel aórtico”.
Fonte: Kouchoukos et al., 2022[7].
O parâmetro utilizado para determinar a DPP é a AEOi – área efetiva do orifício valvar indexada (obtida a partir da fração entre a AEO da prótese a ASC do paciente). A partir disso, pode-se classificar a DPP aórtica em moderada (AEOi entre 0,65 e 0,85 cm2/m2) e severa (se < 0,65 cm2/m2). A partir do último Consórcio de Pesquisa da Academia Valvar 3 (Valve Academy Research Consortium 3 – VARC3) para pacientes com índice de massa corpórea (IMC) acima de 30, deve-se corrigir os valores de DPP moderada entre 0,55 e 0,70 cm2/m2 e DPP severa para valores abaixo de 0,55 cm2/m2[8]. Essa classificação é de extrema importância, já que a DPP possui uma prevalência relativamente alta (de 20 a 70% no primeiro caso e de 5 a 20% no último) e ainda, se for acentuada, está correlacionada a um aumento de 1,8 vez na mortalidade, tanto em fases precoces quanto tardias[9], principalmente em pacientes com fração de ejeção reduzida do ventrículo esquerdo[4]. A DPP também está ligada à diminuição da capacidade funcional e ao processo acelerado de degeneração de próteses biológicas. Portanto, ao calcular previamente a AEOi com base na prótese de um fabricante, se o resultado indicar qualquer grau de DPP, o cirurgião deve considerar alternativas, como usar uma prótese diferente com AEO superior, visto que há diferenças no orifício efetivo valvar, a depender da prótese escolhida, seja ela mecânica, seja biológica, com coxins para ancoragem dos pontos cirúrgicos, sem sutura ou de rápida implantação, sendo as duas últimas as opções com maior AEO[4]. Outra opção seria a ampliação cirúrgica do anel aórtico para acomodar um substituto valvar de tamanho adequado. No entanto, a segurança e os benefícios a longo prazo da AAA junto à troca da valva aórtica (TVA) ainda são motivo de controvérsia.
Bases de dados americanas apontam que 22 a 44% das próteses aórticas implantadas nos Estados Unidos têm tamanho menor ou igual a 21 mm. Destas, 88 a 91% são em pacientes do sexo feminino[4,10]. Pelo formato elipsoide do anel aórtico (eixo sagital avaliado por ecocardiografia transtorácica menor que eixo coronal), é preconizado que sua análise pré-operatória seja feita com ecocardiografia transesofágica em três dimensões, tomografia computadorizada ou ressonância magnética[4,10]. Outro fato a ser considerado foi o relato de menor incidência de DPP em pacientes submetidos à troca da valva aórtica transcateter em relação às trocas cirúrgicas, muito disso em virtude do oversizing das próteses transcateter de até 20% em relação ao anel aórtico[4]. Estudo recente apresentado no Transcatheter Cardiovascular Therapeutics de 2023 e publicado na revista Circulation, o VIVA trial comparou pacientes submetidos a tratamento cirúrgico e transcateter da valva aórtica, os quais por definição apresentavam anel aórtico pequeno em relação à desproporção paciente-prótese, e mortalidade pós-operatória em dois anos. Esse foi o primeiro estudo prospectivo realizado quanto ao assunto, em que foram analisados 151 pacientes com diâmetro aórtico médio menor que 23 mm. Foram submetidos à cirurgia aberta 74 pacientes e ao tratamento transcateter, 77 pacientes. Como resultado, entre as duas terapias, não houve diferença em dois anos na mortalidade, no número de hospitalizações e na estenose aórtica severa pós-procedimento[11].
Nesse sentido, Yu et al. conduziram uma meta-análise, que incluiu 8.561 pacientes, dos quais 2.570 foram submetidos à AAA[12]. O grupo em questão apresentou aumento nos tempos de pinçamento aórtico e circulação extracorpórea, e esses resultados estão em consonância com um extenso estudo de coorte retrospectivo, publicado simultaneamente[13]. Por outro lado, não houve diferença de mortalidade precoce, necessidade de implante de marca-passo, reoperação por sangramento ou acidente vascular cerebral ente os grupos. Além disso, o risco de DPP moderada e grave foi menor quando a AAA foi associada à TVA. É aceito hoje que o aumento da raiz aórtica é indicado principalmente para prevenir o risco de DPP grave[14]. A indicação para DPP moderada é mais controversa, com alguns estudos sugerindo efeitos insignificantes na morbidade e mortalidade. Assim, é recomendado cautela ao evitar prospectivamente a DPP moderada, pois o risco operatório pode superar os benefícios no tratamento desse tipo de DPP[2]. Em seus estudo, Head et al. (27.186 pacientes), Takagi et al. (16.021 pacientes), Chen et al. (14.874 pacientes) e Davan et al. (40.381 pacientes) avaliaram pacientes após troca da valva aórtica com DPP moderada e severa. Com um total de 98.462 pacientes analisados, aqueles com DPP severa apresentaram 31 a 56% maior mortalidade em 10 anos quando comparados com pacientes com DPP moderada e os demais[8].
As técnicas de AAA são tradicionalmente divididas em duas categorias: técnicas de alargamento posterior (técnicas de Nicks e Manouguian) e ampliação anterior complexa (procedimento de Konno-Rastan). O procedimento de Nicks, proposto em 1970[7], estende a incisão de aortotomia até o seio de Valsava da válvula não coronariana para ampliar o anel. Em seguida, o átrio esquerdo é aberto para visualizar a cúspide anterior da valva mitral, que é seccionada para ampliar a via de saída do ventrículo esquerdo. Um patch é adaptado à incisão e unido com fio de polipropileno 4-0. Por fim, a prótese valvar aórtica é escolhida, fixada ao anel aórtico e a aorta é suturada (Figura 2). A técnica de Manouguian, de 1979, segue passos semelhantes, mas a incisão se encontra entre as cúspides esquerda e não coronariana, podendo se estender até a cortina mitral anterior. Há ainda uma variação chamada de Manouguian-Nunez, na qual a incisão não vai até o folheto mitral anterior (Figura 3).
O procedimento de Konno-Rastan, apresentado em 1975, é uma intervenção complexa que envolve uma incisão anterior e aortoventriculoplastia[7]. Consiste na seção longitudinal anterior da aorta, cardiomiotomia pelo seio coronário direito, anel aórtico, septo interventricular e superfície anterior do ventrículo direito, ampliando a via de saída deste último. Utiliza-se um reparo de remendo duplo para corrigir defeitos na aorta, septo interventricular e via de saída do ventrículo direito (VSVD). Precauções são necessárias para evitar lesões no sistema de condução cardíaca e na artéria coronária direita[7]. O procedimento de Konno-Rastan (Figura 4), apesar de apresentar maior complexidade e risco operatório, permite uma ampliação mais significativa em comparação às técnicas de Nicks e Manouguian. Enquanto as duas últimas aumentam o tamanho em até duas vezes, o Konno-Rastan possibilita um alargamento ainda maior, podendo atingir três a quatro tamanhos de aumento. No entanto, o procedimento de Nicks continua sendo o mais realizado, provavelmente por sua execução mais fácil e curva de aprendizado mais rápida[14].
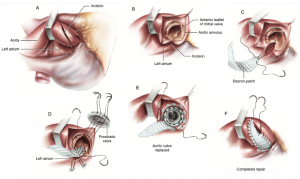
Figura 2. Exemplificação da técnica de Nicks com a realização da incisão por entre a cúspide não coronariana para ampliar o anel.
Fonte: Barbosa Filho, 2021[13].
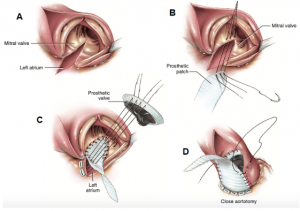
Figura 3. Exemplificação da técnica de Manouguian com realização da incisão a partir da comissura entre as
válvulas semilunares aórticas posterior e esquerda, para ampliar o anel.
Fonte: Barbosa Filho, 2021[13].
Em 2021, Yang propôs uma incisão em Y (Figura 5), aumentando a parte fibrosa do anel aórtico sem afetar o anel basal. Há preocupações quanto a estenoses subaórticas futuras, torções da artéria coronária esquerda em sua origem (pela mobilização do seu óstio no ato cirúrgico) e velocidade da degeneração valvar. Em 2022, também foi proposta a técnica de Roof, derivada da técnica de Yang, mas sua incisão se estende em Y até parte da aorta ascendente[10,11].
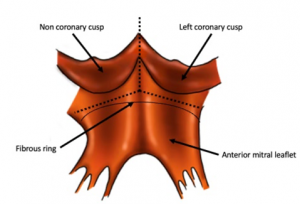
Figura 5. Técnica de Yang. Visão da raiz da aorta de sua face interna. Incisão em Y entre folhetos não coronariano e
coronariano esquerdo se estendendo pela comissura entre eles.
Fonte: Fazmin et al., 2023[8].
Mesmo com a AAA representando menos de 10% de todos os procedimentos de substituição da válvula aórtica no banco de dados STS[8,9], sua adesão está em ascensão, pois a DPP está sendo cada vez mais reconhecida como uma questão significativa a ser abordada. Visando isso, Freitas-Ferraz et al.[4] sugerem um algoritmo para tratamento desses pacientes. (Fluxograma 1). A análise cuidadosa das técnicas é essencial para a escolha adequada para cada paciente. A promoção de eventos e debates sobre o tema, bem como o estímulo à pesquisa e ao treinamento adequado da equipe cirúrgica, é fundamental para a disseminação segura dessa prática. Enquanto respostas de longo prazo aguardam mais pesquisas, é crucial continuar o trabalho visando evitar complicações pós-operatórias aos pacientes, mesmo com próteses normofuncionantes.
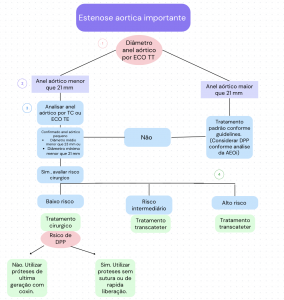
Fluxograma 1. Fluxograma para pacientes com estenose aórtica importante e anel aórtico pequeno. AEOi: área efetiva do orifício valvar indexada para superfície corpórea; DPP: desproporção paciente-prótese; ECO TE: ecocardiograma transesofágico; ECO TT: ecocardiograma transtorácico; TC: tomografia computadorizada.
Fonte: adaptado de Freitas-Ferraz et al., 2019[4].
Referências
1Margutti R, Borges S, Campos Filho CM, Gallucci C, Branco Jr LB. Tratamento cirúrgico da estenose valvular aórtica. Rev Paulista Med. 1955;46:82-91.
2Sociedade Brasileira de Cardiologia. A prótese valvar cardíaca definitiva: meio século de procura. Disponível em: http://publicacoes.cardiol.br/caminhos/013/default.asp. Acesso em 16 set. 2024.
3Sant´anna JR, Kalil RAK, Prates PR, Jungblut C, Nesralla IA. Dupla ampliação anterior e posterior do anel aórtico para substituição valvar. Braz J Cardiovasc Surg. 2002;17(1):35-46. doi: 10.1590/S0102-76382002000100007.
4Freitas-Ferraz AB, Tirado-Conte G, Dagenais F, Ruel M, Al-Atassi T, Dumont E, et al. Aortic stenosis and small aortic annulus. Circulation. 2019;139(23):2685-702. doi: 10.1161/CIRCULATIONAHA.118.038408. Epub 2019 Jun 3. PMID: 31157994.
5Rossebø AB, Pedersen TR, Boman K, Brudi P, Chambers JB, Egstrup K, et al.; SEAS Investigators. Intensive lipid lowering with simvastatin and ezetimibe in aortic stenosis. N Engl J Med. 2008;359(13):1343-56. doi: 10.1056/NEJMoa0804602. Epub 2008 Sep 2. PMID: 18765433.
6Oliveira MAB, Alves FT, Silva MVP, Croti UA, Godoy MF, Braile DM. Conceitos de física básica que todo cirurgião cardiovascular deve saber. Parte 1 – Mecânica dos fluidos. Rev Bras Cir Cardiovasc. 2010;25(1):1-10.
7Pibarot P, Dumesnil JG. Prosthesis-patient mismatch: definition, clinical impact, and prevention. Heart. 2006;92:1022-9. doi: 10.1136/hrt.2005.067363.
8Fazmin IT, Ali JM. Prosthesis-patient mismatch and aortic root enlargement: indications, techniques and outcomes. J Cardiovasc Dev Dis. 2023;10(9):373. doi: 10.3390/jcdd10090373. PMID: 37754802; PMCID: PMC10531615.
9Kalender M, Fedakar A, Adademir T, Salihi S, Boyacıoğlu K, Özbek B, et al. Trends in mechanical aortic valve replacement surgery in a large, multi-surgeon, single hospital practice. Kardiochir Torakochirurgia Pol. 2014;11(4):367-72. doi: 10.5114/kitp.2014.47334. Epub 2014 Nov 30.
10Yang B. A novel simple technique to enlarge the aortic annulus by two valve sizes. JTCVS Tech. 2021;5:13-6. doi: 10.1016/j.xjtc.2020.10.038. Epub 2020 Nov 5. PMID: 33623928; PMCID: PMC7899136.
11Rodés-Cabau J, Ribeiro H, Mohammadi S, Serra V, Al-Atassi T, Iniguez A, et al.; VIVA Trial Investigators. Transcatheter or surgical aortic valve replacement in patients with severe aortic stenosis and small aortic annulus: a randomized clinical trial. Circulation. 2023. doi: 10.1161/CIRCULATIONAHA.123.067326. Epub ahead of print. PMID: 37883682.
12Yu W, Tam DY, Rocha RV, Makhdoum A, Ouzounian M, Fremes SE. Aortic root enlargement is safe and reduces the incidence of patient-prosthesis mismatch: a meta-analysis of early and late outcomes. Can J Cardiol. 2019;35:782-90. doi: 10.1016/j.cjca.2019.02.004.
13Haunschild J, Scharnowski S, Mende M, von Aspern K, Misfeld M, Mohr FW, et al. Aortic root enlargement to mitigate patient–prosthesis mismatch: do early adverse events justify reluctance?† Eur J Cardio-Thorac Surg. 2019;56:335-42. doi: 10.1093/ejcts/ezz016.
14Mack MJ, Adams DH. Avoidance of patient prosthesis mismatch after aortic valve replacement. J Am Coll Cardiol. 2023;81:976-8. doi: 10.1016/j.jacc.2023.01.011.
Sugestões de leitura
Barbosa Filho A. As diferentes estratégias no arsenal do cirurgião para ampliar a raiz aórtica: cenário, descrição e discussões técnicas. Brazilian Journal of Cardiovascular Surgery [Internet]. 2021. Disponível em: https://blog.bjcvs.org/single-post/2021/12/10/as-diferentes-estrategias-no-arsenal-do-cirurgiao-para-ampliar-a-raiz-aortica-cenario-descricao-e-discussoes-tecnicas/. Acesso em 16 set. 2024.
Harken DE, Soroff HS, Taylor WJ. Parcial and complete prosthesis in aortic insufficiency. J Thorac Cardiovasc Surg, 1960;40:744-62.
Kouchoukos NT, Blackstone EH, Hanley FL, Kirklin JK, eds. Kirklin/Barratt-Boyes cardiac surgery. 4. ed. Philadelphia: Elsevier Saunders; 2012.
Massias SA, Pittams A, Mohamed M, Ahmed S, Younas H, Harky A. Aortic root enlargement: when and how. J Card Surg. 2021;36:229-35. doi: 10.1111/jocs.15175.
Otto ME, Atik FA, Moreira MN, Ribeiro LCM, Mello BCR, Lima JGE, et al. Desproporção de prótese aórtica no sistema público. Arq Bras Cardiol. 2020;114(1):12-22.
Tam DY, Rocha RV, Wijeysundera HC, Austin PC, Dvir D, Fremes SE. Surgical valve selection in the era of transcatheter aortic valve replacement in the Society of Thoracic Surgeons Database. J Thorac Cardiovasc Surg. 2020;159:416-27.e8. doi: 10.1016/j.jtcvs.2019.05.081.
3