Historicamente, o desenvolvimento gradativo da cirurgia cardiovascular foi intimamente relacionado à cirurgia de revascularização do miocárdio (RM) no tratamento da angina pectoris, evidente através de estudos notáveis como o de Alexis Carrel que realizou anastomose entre a porção descendente torácica da aorta e a artéria coronária esquerda de um cão no ano de 1910, utilizando um longo homoenxerto de artéria carótida1. Em 1945, Arthur Vineberg implantou a artéria torácica interna diretamente no miocárdio como resultado de suas pesquisas prévias, mas não na coronária2. Já o pioneirismo da revascularização coronariana com sutura ocorreu em 25 de fevereiro de 1964 através de Vasilii Kolesov, concluindo uma anastomose entre as artérias torácica interna esquerda e coronária circunflexa, fruto de suas pesquisas prévias1,3. O papel de René Favaloro recebe importância não de inventor, uma vez que realizou interposição de coronária com enxerto de safena em 9 de maio de 1967 e na forma aortocoronariana em 19 de outubro do mesmo ano, mas inegavelmente impulsionou a RM, facilitando sua introdução na rotina prática dos centros hospitalares ao redor do mundo1,4.
O desenvolvimento do aparelho coração-pulmão artificial em 6 de maio de 1953 por John Gibbon5, que provê a circulação extracorpórea (CEC), sem dúvidas dividiu a cirurgia cardíaca em duas eras: pré e pós-CEC. Esta possibilitou maior exploração cirúrgica do coração e se deu foco ao desenvolvimento da revascularização miocárdica, sobretudo com o declínio precoce dos primeiros transplantes cardíacos devido à alta rejeição na era pré-ciclosporina. De forma isolada, a RM correspondeu a 54% das cirurgias cardíacas realizadas em 2016 nos Estados Unidos6, justificando a frase “a cirurgia de revascularização do miocárdio está para o cirurgião cardíaco, assim como a apendicectomia para o cirurgião geral” de autoria desconhecida.
Apesar do avanço tecnológico ao longo dos anos, tornaram-se perceptíveis os possíveis efeitos indesejáveis da CEC, como por exemplo: hemorragia; síndrome de baixo débito cardíaco; arritmias; insuficiência respiratória e/ou renal; acometimento neurológico ou neuropsiquiátrico; distúrbios hidroeletrolíticos; hemólise; inflamação; febre; distúrbio vasomotor (vasoconstricção arterial); embolia arterial e dissecção aórtica5,7. Os fatores que desempenham papel preponderante nos danos ao organismo são: a interação entre os componentes mecânicos e artificiais do ACPA e o sangue do paciente; fluxo contínuo (não-pulsátil) da máquina; hemodiluição; hipotermia; anticoagulação e pinçamento aórtico5,7,8. A atenção se voltou à possibilidade de revascularizar as coronárias sem auxílio da CEC, com Trapp e Bisarya reportando uma série de 63 casos de revascularização miocárdica sem CEC ao empregar um sistema de perfusão complexo (Figura 1) que envolvia os lúmens proximal e distal da coronária e a parede da aorta ascendente, havendo apenas um óbito9.
Figura 1. Dispositivo para perfusão da artéria coronária a ser revascularizada envolvendo cânulas nas porções proximal e distal da coronária aberta, além de cânula para a aorta ascendente formando complexo sistema.
Fonte: Trapp WG e Bisarya R.9.
Os cirurgiões iniciaram a realizar revascularizações sem CEC em pacientes selecionados, observando desde redução da morbimortalidade e infarto transoperatório até a também redução do tempo de internação hospitalar, culminando em menor custo hospitalar7. Entretanto, três inconvenientes até então intrínsecos à RM sem CEC eram claros: isquemia (em até 30% dos pacientes); campo cirúrgico com muito sangue e a possibilidade de sutura inadvertida da parede posterior da coronária7. A isquemia era secundária ao uso de torniquetes poderiam provocar infarto transoperatório, enquanto o campo cirúrgico sangrento dificultava a visualização das paredes da coronária e consequentemente a sutura da parede posterior da coronária tornava-se possível7. Tendo em vista o potencial da revascularização sem CEC, o cirurgião cardiovascular brasileiro e grande inventor, Luiz Antônio Rivetti idealizou um tubo de silicone macio com 3 centímetros de comprimento para introduzir nas porções proximal e distal da coronária aberta em seu local de anastomose, assim como havia um fio de polipropileno 4-0 envolto em sua metade para o momento da retirada (Figuras 2 e 3C)7. Era então criado o “shunt intraluminal temporário”, fruto da perspicácia do professor Rivetti que iniciou sua introdução na Santa Casa de São Paulo em 1983 e obteve excelentes resultados operando 63 pacientes até 1991 sem trombose nos shunts e qualquer lesão à coronária ou vaso enxertado e nenhum óbito7. Outros 419 pacientes foram operados até o início de 1997 com resultados favoráveis.
O racional do shunt intraluminal temporário proposto por Rivetti está em manter o fluxo ao território distal da incisão, uma vez que há obstrução coronariana, mas não oclusão, e sem o uso de cardioplegia é necessário prover o fluxo que ultrapassava a obstrução a fim de evitar infarto transoperatório. Outro benefício reside no campo cirúrgico sem o constante sangramento e a sutura facilitada, visto que eliminava o risco de sutura da parede posterior da coronária e o dispositivo era removido antes do término da sutura. As taxas de complicação se equiparavam às cirurgias com CEC, porém caso os pacientes selecionados e operados sem CEC realizassem a cirurgia com auxílio da mesma, poderiam ter resultados desfavoráveis mais facilmente pelos riscos da circulação extracorpórea. A mudança do cenário era clara.

Figura 2. Shunt intraluminal temporário sendo introduzido em artéria coronária, sendo vistas por transparência sua acomodação nas porções proximal e distal do vaso, além de seu fio envolto na parte média para a retirada.
Fonte: Ramponi F et al.10.
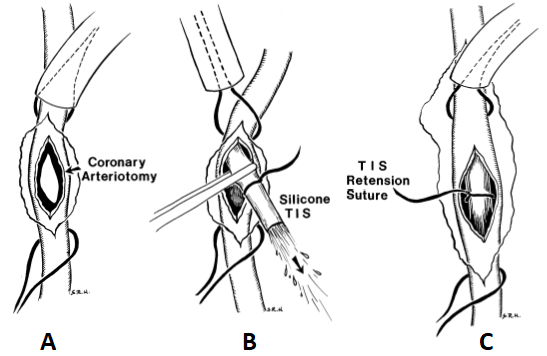 Figura 3. (A) Abertura do epicárdio e arteriotomia da coronária a ser revascularizada e torniquete proximal posicionado. (B) Implante do shunt intraluminal temporário e visualização do fluxo arterial coronariano. (C) Ilustração do aspecto ao posicionamento do dispositivo e aplicação do torniquete proximal.
Figura 3. (A) Abertura do epicárdio e arteriotomia da coronária a ser revascularizada e torniquete proximal posicionado. (B) Implante do shunt intraluminal temporário e visualização do fluxo arterial coronariano. (C) Ilustração do aspecto ao posicionamento do dispositivo e aplicação do torniquete proximal.
Fonte: modificado de Rivetti LA, Gandra SMA7.
Vários trabalhos foram iniciados para avaliar o melhor método em relação aos desfechos, isto é, com ou sem CEC, e os principais estudos publicados até o momento são o ROOBY-FS11, CORONARY8, GOPCABE12 e MASS III13. O ROOBY-FS (Veterans Affairs Randomized On/Off Bypass Follow-up Study) randomizou 2203 pacientes em 18 hospitais dos Estados Unidos entre 2002 e 2007 e apontou desfechos primários favoráveis à RM com CEC em detrimento da RM sem CEC, visto que a taxa de morte em 5 anos foi respectivamente de 11.9% e 15.2% (P=0.02) e eventos cardiovasculares adversos (morte por qualquer causa, nova revascularização por CRM ou intervenção percutânea e infarto do miocárdio não-fatal) de 27.1% e 31.0%, respectivamente (P=0.046)11. Contudo, apesar do desfecho primário de eventos cardiovasculares adversos ser favorável à RM com CEC ao excluirmos os crossovers (N=2026), o mesmo não acontece quanto desfecho de morte em 5 anos cuja estatística não demonstra diferença significativa entre o grupo com CEC (11.0%) e sem CEC (13.5%) (P=0.09) apesar do estudo concluir que além de maiores efeitos adversos no grupo sem CEC, também houve menor sobrevida11. Ainda, não houve diferença estatística em relação aos desfechos secundários de morte por causas cardíacas, nova revascularização e infarto do miocárdio não-fatal, contudo é prudente sinalizar que o estudo recebeu diversas críticas pela inexperiência dos cirurgiões realizando a cirurgia sem CEC com média de 120 casos e mediana de 50, além de utilizarem casos em que residentes foram cirurgiões principais11.
O estudo CORONARY (CABG Off or On Pump Revascularization Study) randomizou entre 2006 e 2011, 4752 pacientes em 4 continentes englobando 19 países, incluindo o Brasil, para avaliar os desfechos em 5 anos entre os grupos de RM com CEC e sem CEC em cirurgias isoladas e via esternotomia mediana8. Não houve diferença estatística significante no desfecho composto de morte, acidente vascular encefálico, infarto do miocárdio, insuficiência renal ou nova revascularização (cirúrgica ou percutânea) entre os grupos com e sem CEC, respectivamente 23.6% e 23.1% (P=0.72), também não havendo diferença significativa ao analisar tais componentes isoladamente8. O desfecho secundário foi o custo em dólares americanos, não sendo diferente estatisticamente com CEC (U$14,992) ou sem CEC (U$15,107), reduzindo ainda mais ao aplicar os descontos (diferença de U$96)8. Contudo cabe ressaltar que não foi realizada uma análise padrão de custo-efetividade com a limitação da não-inclusão de custos específicos como afastadores para RM sem CEC e circuitos da CEC devido à política de confidencialidade de custo dos hospitais8. Sabidamente, os circuitos da CEC não são reutilizáveis, mas há afastadores da cirurgia sem CEC que são reutilizáveis e isso poderia provocar diferença maior em custos a favor da cirurgia sem CEC8. Diferentemente do ROOBY-FS, o CORONARY empregou resultados de cirurgiões com experiência superior a 2 anos após a residência e com mais de 100 casos de cada cirurgia, sem residentes como cirurgiões principais8.
Os estudos CORONARY e ROOBY-FS não explicitaram quais equipamentos empregados na cirurgia sem CEC, como o estabilizador Octopus (Figura 4) e o posicionador Starfish, ambos da Medtronic, ou do shunt intraluminal temporário que é um aliado contra o agravamento da isquemia no ato cirúrgico, facilita a anastomose e evita inconvenientes.
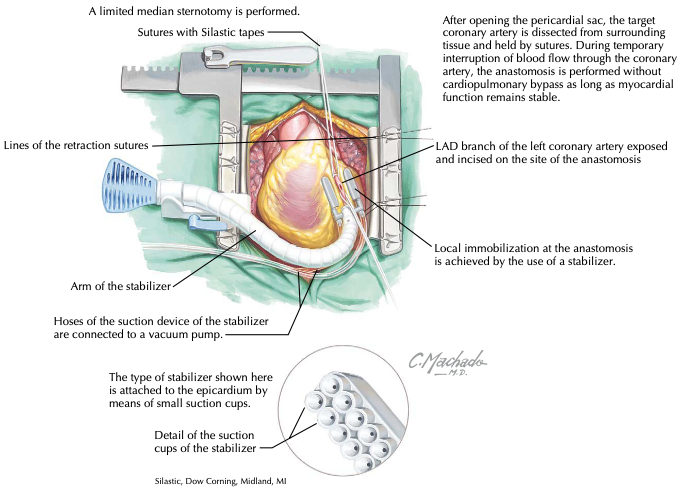 Figura 4: Cirurgia de revascularização do miocárdio sem CEC com aplicação do estabilizador Octopus, que atua com ventosas em suas barras laterais, no terço médio do ramo interventricular anterior para facilitar a anastomose da artéria torácica interna esquerda, padrão-ouro.
Figura 4: Cirurgia de revascularização do miocárdio sem CEC com aplicação do estabilizador Octopus, que atua com ventosas em suas barras laterais, no terço médio do ramo interventricular anterior para facilitar a anastomose da artéria torácica interna esquerda, padrão-ouro.
Fonte: Runge MS, Patterson C, Stouffer GA14.
O estudo GOPCABE (German Off-Pump Coronary Artery Bypass Grafting in Eldery Patients) foi um estudo randomizado, controlado e multicêntrico ocorrido em 12 centros alemães entre 2008 e 2011 objetivando a análise dos benefícios da RM sem CEC quando comparada ao seu uso, em população idosa (definida como ≥75 anos), cuja média foi de 78 anos, e demonstrou os resultados após um ano12. Após um ano, foram analisados 1179 pacientes no grupo sem CEC e 1191 no grupo com CEC, sendo o desfecho primário composto por morte, acidente vascular encefálico, infarto do miocárdio, nova revascularização ou terapia renal de substituição após a cirurgia, enquanto o desfecho secundário incluiu os tempos cirúrgico e de intubação, permanência na unidade de terapia intensiva e no hospital, além da realização de transfusão sanguínea12. O estudo foi concebido de forma que houvessem cirurgiões determinados previamente a realizar somente uma das técnicas e os que as realizaram sem CEC haviam uma média de 514 casos (mediana de 322) previamente, enquanto no grupo com CEC a média era de 1378 casos (mediana de 578), denotando experiência dos participantes112. Não houve diferença entre os grupos sem CEC e com CEC no desfecho composto, enquanto os desfechos secundários indicaram menor necessidade de transfusão (56.3% e 62.7%, respectivamente) e menor quantidade de bolsas em casos administrados (2 e 2.4, respectivamente) enquanto os demais desfechos foram similares12. Vale destaque à descrição do uso de estabilizador para anastomose, mas não há menção ao shunt intraluminal temporário. A conclusão foi de não haver benefício significante em idosos submetidos à RM sem CEC, contudo a avaliação das técnicas foi prejudicada ao engessar os cirurgiões a realização apenas uma durante todo o estudo, podendo haver diferenças de resultados.
Um estudo randomizado brasileiro para avaliar as duas técnicas em pacientes com doença coronariana multiarterial foi realizado no Instituto do Coração do Hospital das Clínicas da Universidade de São Paulo (InCorHCFMUSP) entre 2001 e 2006, denominado MASS III, incluindo 308 pacientes entre RM sem CEC (N=155) e com CEC (N=153) acompanhados por cinco anos13. O desfecho composto primário englobou morte, infarto do miocárdio, nova revascularização ou acidente vascular encefálico, ao passo que ausência de angina e isquemia induzida por teste ergométrico foram os desfechos secundários e não houve diferença estatisticamente significativa nos desfechos primário e secundário13. Porém os tempos cirúrgico, de extubação e até a alta foram significativamente menores em favor dos pacientes revascularizados sem CEC (240±65 versus 300±87.5 minutos) (P<0.001); (4.6±6.8 versus 9.3±5.7) (P<0.001) e (6±2 versus 9±2 dias) (P<0.001), respectivamente, assim como menos transfusões (31% versus 61%) (P<0.001) e menores níveis máximos de CK-MB (14.4±17.6 versus 28.0±34.5 UI/L) (P<0.001)13. Por outro lado, a incidência de fibrilação atrial foi maior no grupo sem CEC (35% versus 4%) (P<0.001) e o número de coronárias revascularizadas foi maior com CEC (2.97 versus 2.49) (P<0.001)13. O estudo reportou o uso de estabilizadores para a cirurgia sem CEC com descarte após o uso, porém o shunt intraluminal temporário não foi rotina e tampouco descrito quantos foram aplicados e seus resultados isolados para análise com o grupo sem utilização. Os custos foram maiores no grupo sem CEC, em parte atribuídos à não reutilização dos estabilizadores de coronária e perfusionistas em sobreaviso caso conversão cirúrgica fosse necessária, entretanto não foi demonstrado valor comparativo e os tempos cirúrgico e de hospitalização reduzidos em favor da RM sem CEC merecem relevância, com possível influência no custo final.
A cirurgia de revascularização do miocárdio já se mostrou superior à intervenção coronariana percutânea, sobretudo na população diabética e o estudo CORONARY avaliou o subgrupo de diabéticos operados com CEC (N=294) e sem CEC (N=250) em seu desfecho que incluiu morte, acidente vascular encefálico, infarto do miocárdio, nova insuficiência renal necessitando terapia dialítica ou nova revascularização (cirúrgica ou percutânea), sendo 26.1% acometidos com CEC contra 22.7% sem CEC (P=0.06), demonstrando que essa população se beneficia sem o uso da CEC8. O estudo ROOBY-FS citou benefícios da CRM sem CEC em pacientes com aorta calcificada (em porcelana), pois não há manipulação da mesma com clampeamento e são evitados acidentes tromboembólicos11.
Neste cenário, a diretriz de 2018 da ESC/EACTS de revascularização do miocárdio recomenda a realização da cirurgia sem CEC e anaórtica, isto é, sem manipular a aorta, por equipes experientes, em pacientes com doença aterosclerótica grave na aorta (Classe I, nível de evidência B) e considerada em pacientes de alto risco, também por cirurgiões habituados à técnica sem CEC (Classe IIa e nível de evidência B)15. Também há certa evidência em favor da RM sem CEC nos pacientes com doença renal crônica, por reduzir tanto a mortalidade intra-hospitalar, quanto a necessidade da terapia renal de substituição15. A existência de um seleto grupo de pacientes que se beneficia da cirurgia sem a circulação extracorpórea é clara, enquanto a CEC segue bem aplicada às diversas cirurgias cardiovasculares, incluindo procedimentos desde a revascularização do miocárdio, perpassando a atuação nas cardiopatias congênitas até os transplantes cardíacos e implantes de dispositivos de assistência ventricular. São necessários novos estudos randomizados multicêntricos com maior duração, a fim de avaliar ainda mais os desfechos tardios e com descrição dos materiais empregados, ao menos, visto que a avaliação custo-efetividade esbarra nas políticas hospitalares de confidencialidade dos valores.
Referências
1. Rocha EAV. Fifty years of coronary artery by-pass graft surgery. Braz J Cardiovasc Surg. 2017;.32(4):II-III. doi: 10.21470/1678-9741-2017-0104.
2. Konstantinov IE. Robert H. Goetz: the surgeon who performed the first successful clinical coronary artery bypass operation. Ann Thorac Surg. 2000;69:1966-1972.
3. Konstantinov IE. The first coronary artery bypass operation and forgotten pioneers. Ann Thorac Surg. 1997;64:1517-1528.
4. Jones DS. CABG at 50 (or 107?) – the complex course of therapeutic innovation. N Engl J Med. 2017;376(19):1809-1811. doi: doi:10.1056/NEJMp1702718.
5. Passaroni AC, Silva MAM, Yoshida WB. Cardiopulmonary by-pass: development of John Gibbon’s heart-lung machine. Braz J Cardiovasc Surg. 2015;30(2):235-245. doi: 10.5935/1678-9741.20150021.
6. D’Agostino RS, Jacobs JP, Badhwar V, Fernandez FG, Paone G, Wormuth DW, et al. The society of thoracic surgeons adult cardiac surgery database: 2018 update on outcomes and quality. Ann Thorac Surg. 2018;105(1):15-23. doi:10.1016/j.athoracsur.2017.10.035.
7. Rivetti LA, Gandra SMA. Initial experience using an intraluminal shunt during revascularization of the beating heart. Ann Thorac Surg. 1997;63:1742-1747.
8. Lamy A, Devereaux PJ, Prabhakaran D, Taggart DP, Hu S, Straka Z, et al. Five-year outcomes after off-pump or on-pump coronary-artery bypass grafting. N Engl J Med. 2016;375(24):2359-2368. doi:10.1056/ NEJMoa1601564.
9. Trapp WG, Bisarya R. Placement of coronary artery bypass graft without pump oxygenator. Ann Thorac Surg. 1975;19(1):1-9.
10. Ramponi F, Seco M, Edelman JB, Sherrah AG, Bannon PG, Brereton RJ et al. Dual inflow, total-arterial, anaortic, off-pump coronary artery bypass grafting: how to do it. Ann Cardiothorac Surg 2018;7(4):552-560. doi: 10.21037/acs.2018.06.17.
11. Shroyer AL, Hattler B, Wagner TH, Collins JF, Baltz JH, Quin JA, et al. Five-year outcomes after on-pump and off-pump coronary-artery bypass. N Engl J Med. 2017;377(7):623-632. doi: 10.1056/NEJMoa1614341.
12. Diegeler A, Börgermann J, Kappert U, Breuer M, Böning A, Ursulescu A, et al. Off-pump versus on-pump coronary-artery bypass grafting in eldery patients. N Engl J Med. 2013;368:1189-1198. doi: 10.1056/NEJMoa1211666.
13. Hueb W, Lopes NH, Pereira AC, Hueb AC, Soares PR, Favarato D, et al. Five-year follow-up of a randomized comparison between off-pump and on-pump stable multivessel coronary artery bypass grafting. The MASS III trial. Circulation. 2010;122:48-52. doi: 10.1161/CIRCULATIONAHA.109.924258.
14. Runge MS, Patterson C, Stouffer GA. Netter’s Cardiology. 2nd ed. Piladelphia: Elsevier Saunders; 2010.
15. Neumann FJ, Sousa-Uva M, Ahlsson A, Alfonso F, Banning AP, Benedetto U, et al. 2018 ESC/EACTS guidelines on myocardial revascularization. Eur Heart J. 2019;40(2):131-133. doi:10.1093/eurheartj/ehy394.