O ano de 1964 foi marcado pela revascularização da artéria coronária circunflexa de um paciente através da artéria torácica interna esquerda, realizada por Vasilii Kolesov em 25 de fevereiro, sendo a primeira revascularização com emprego de sutura1,2,3. Entretanto, o grande impulsionador da cirurgia de revascularização do miocárdio (RM) foi inegavelmente René Favaloro, argentino que atuava na Cleveland Clinic quando realizou uma interposição de veia safena magna, portanto com anastomoses término-terminais na artéria coronária aterosclerótica em 19 de maio de 1967, enquanto a forma aortocoronariana com anastomose término-lateral foi também realizada por Favaloro em 19 de outubro do mesmo ano1,4. A artéria radial, por outro lado, foi introduzida no rol de enxertos para revascularização miocárdica em 1971 com Carpentier, obtendo resultados iniciais frustrantes devido à oclusão em mais de um terço dentre os 30 pacientes após quatro anos, o que levou à posterior avaliação de sua retirada com tecido perivascular e os resultados até cinco anos foram satisfatórios, reforçando a alternativa a partir de então5.
VEIA SAFENA MAGNA
A mais longa veia do corpo humano é a safena magna, que se inicia após a veia marginal medial na face dorsal do pé em cada dimídio, ascendendo anteriormente ao maléolo medial e seguindo pela face medial de cada perna até passar posteriormente aos côndilos mediais da respectiva tíbia e fêmur para continuar cranialmente na face medial de cada coxa, até que 3 centímetros distante do ligamento inguinal se arqueia no hiato safeno, uma fenda da fáscia muscular, para se unir à veia femoral e marcando a denominada junção safeno-femoral6. É importante ressaltar sua sintopia com o nervo safeno, tendo íntima relação em seu trajeto, visto que o nervo safeno pode ser lesado durante a retirada da veia homônima, acarretando parestesia pós-operatória na região do membro inferior. Além disso, vale lembrar que as veias safenas magnas são dotadas de válvulas normalmente bicúspides, já que o fluxo à montante necessita deste mecanismo para evitar refluxo e, desta forma, a veia deve ser enxertada em orientação invertida para evitar resistência ao fluxo aortocoronariano.
Existem duas três formas principais de retirada da veia safena magna: convencional, no touch e endoscópica. A primeira envolve a retirada de todo o pedículo gorduroso que envolve a veia, acometendo sua camada adventícia, além do trauma endotelial provocado pela necessária distensão manual com solução salina que para corrigir espasmos (Figura 1), fatores que comprometem significativamente a patência em longo prazo deste método. A técnica no touch foi proposta pelo cirurgião cardíaco brasileiro Domingos Souza em Örebro, Suécia, no ano de 1989, consistindo na obtenção da veia com seu tecido perivascular (Figura 2) que é composto por adipócitos abarcando fibras tanto elásticas quanto nervosas e vasa vasorum, reduzindo sobremaneira a lesão traumática devido à tal proteção que impede manipulação direta dos instrumentais cirúrgicos, assegurando a integridade da adventícia e consequente ausência de espasmos, tornando desnecessária a distensão manual que lesaria o endotélio; portanto a técnica provê maior perviedade em longo prazo graças à preservação de seu endotélio, permitindo grande produção de óxido nítrico através da enzima óxido nítrico sintetase endotelial (eNOS), diferentemente da técnica convencional7,8.
Um estudo randomizado avaliou a patência da veia safena magna entre ambas as técnicas, com 46 pacientes submetidos à técnica convencional e outros 45 à no touch, sendo a patência da técnica convencional em 1.5, 8.5 e 16 anos, de respectivamente 89%, 77% e 64%, enquanto na técnica no touch 95%, 91% e 83%, respectivamente9,10. Além disso, foram claras as diferenças histológicas (Figura 3) e a constatação post-mortem de veias com tecido necrótico, friável e presença de aterosclerose no grupo convencional em 8 anos, enquanto as veias pela técnica no touch em 9, 12 e até 18 anos, aparentavam processos ateroscleróticos discretos, mais localizados e organizados9,10. Estes fatores elevaram a recomendação do uso de veia safena magna no touch para classe IIa na diretriz de revascularização do miocárdio de 2018 pela European Society of Cardiology (ESC) e European Association for Cardio-Thoracic Surgery (EACTS) com nível de evidência B11.
A retirada endoscópica é opção menos utilizada, mesmo reduzindo complicações relativas à ferida operatória, contudo ainda há carência de avaliação apropriada da perviedade ainda mal esclarecida através deste método e requer estudos futuros11.
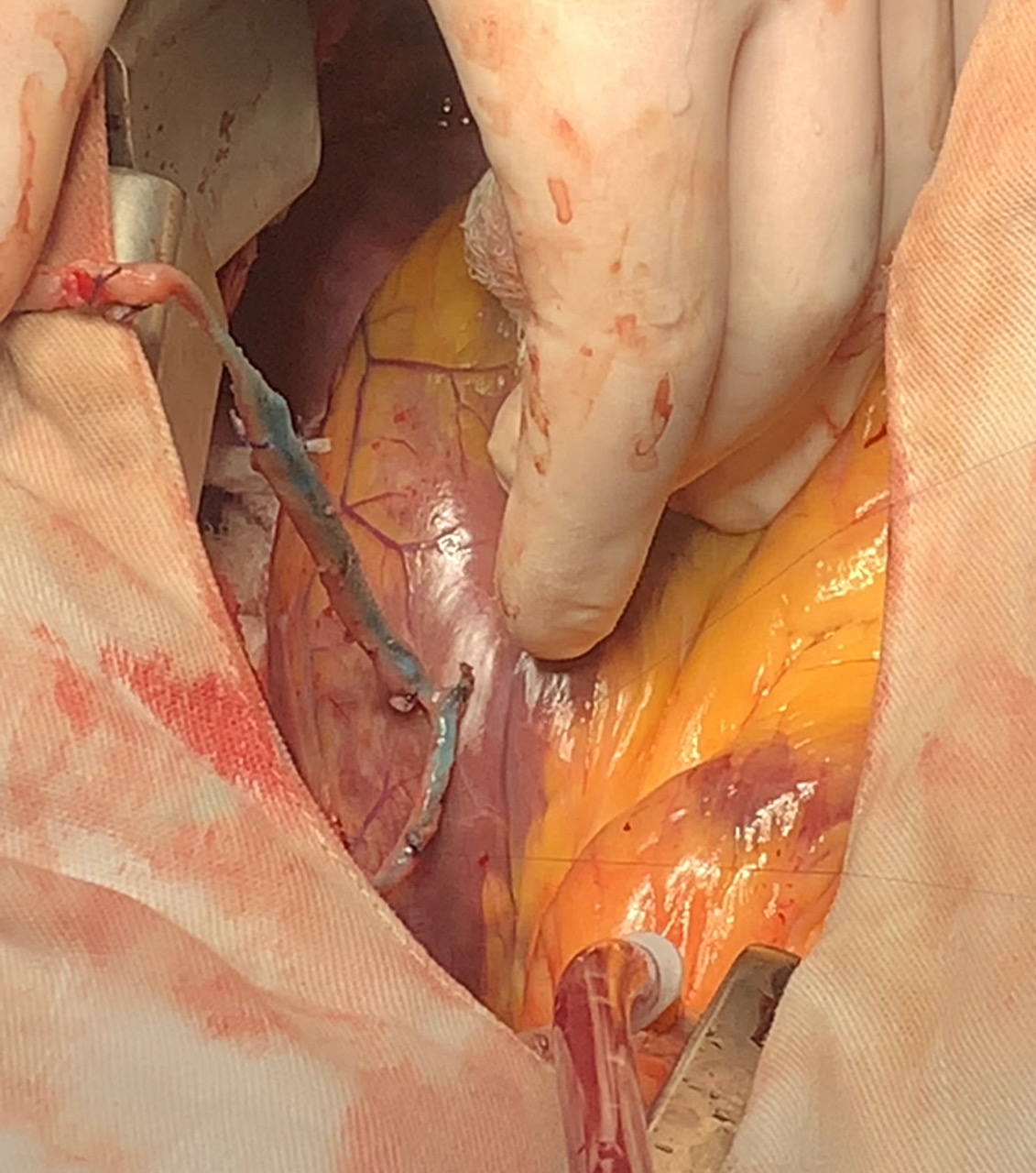 Figura 1. Espasmos evidentes em vários segmentos da veia safena magna obtida pela técnica convencional, que foi distendida logo após a retirada. Na figura, demonstrada nova distensão manual, aproveitando o ensejo para teste da anastomose distal.
Figura 1. Espasmos evidentes em vários segmentos da veia safena magna obtida pela técnica convencional, que foi distendida logo após a retirada. Na figura, demonstrada nova distensão manual, aproveitando o ensejo para teste da anastomose distal.
Fonte: Antonio Carlos de Almeida Barbosa Filho.

Figura 2. Veia safena magna retirada pela técnica no touch em membro inferior esquerdo, evidenciando o tecido perivascular envolvente e já marcado para evitar torção durante a anastomose. As pinças anatômicas tocam no tecido adiposo, mas não atingem as camadas do vaso.
Fonte: Antonio Carlos de Almeida Barbosa Filho.
 Figura 3. Diferenças histológicas entre veia safena magna através da técnica no touch (NT), onde as camadas adventícia (ADV), média/muscular (TM) e lúmen (L) estão íntegras, além da presença da gordura perivascular envolvendo completamente o vaso (PVF). Por outro lado, através do método convencional (C), a adventícia foi arrancada em sua maior parte até o nível da membrana elástica externa (setas), a média/muscular (TM) é pronunciadamente mais fina quando comparada à NT e o lúmen (L) está grosseiramente dilatado, estas duas últimas constatações devido à elevada pressão intraluminal, distendendo-a.
Figura 3. Diferenças histológicas entre veia safena magna através da técnica no touch (NT), onde as camadas adventícia (ADV), média/muscular (TM) e lúmen (L) estão íntegras, além da presença da gordura perivascular envolvendo completamente o vaso (PVF). Por outro lado, através do método convencional (C), a adventícia foi arrancada em sua maior parte até o nível da membrana elástica externa (setas), a média/muscular (TM) é pronunciadamente mais fina quando comparada à NT e o lúmen (L) está grosseiramente dilatado, estas duas últimas constatações devido à elevada pressão intraluminal, distendendo-a.
Fonte: Samano N, Souza D, Pinheiro BB, Kopjar T, Dashwood M10.
ARTÉRIA TORÁCICA INTERNA
A artéria torácica interna é o principal enxerto na RM e popularmente conhecida como “artéria mamária”, sendo seu emprego classe I e nível B na revascularização do território da artéria interventricular anterior segundo a diretriz de 2018 ESC/EACTS11. Anatomicamente é o segundo ramo da primeira porção da artéria subclávia correspondente, percorrendo caudalmente entre os músculos intercostais internos, superficialmente, e profundamente repousa na pleura até o nível da terceira cartilagem costal, quando abaixo desta altura, situa-se sobre o músculo transverso do tórax (Figura 4A e B)6. Está lateralmente e aproximadamente a 1,25cm da linha esternal ipsilateral, sendo responsável por originar as seis primeiras artérias intercostais anteriores, além de emitir ramos esternais, artéria pericardiofrênica, ramos mediastínicos, ramos tímicos, ramos perfurantes e seus ramos terminais: artéria epigástrica superior e artéria musculofrênica, esta última é responsável pela sétima, oitava e nona artérias intercostais anteriores6. O fato de não haver décima e décima primeira artérias intercostais anteriores se deve ao fato que os dois últimos pares de espaços intercostais são incompletos anteriormente graças aos dois últimos pares de costelas, ditas “flutuantes”. Nas mulheres, os ramos perfurantes do segundo e terceiro espaços intercostais emitem ramos mamários que se dirigem à glândula mamária e tornam-se dilatados na lactação6.

Figura 4. (A) Artéria torácica interna esquerda e seu percurso desde a origem, posteriormente à veia subclávia ipsilateral, até sua bifurcação em artérias epigástrica superior e musculofrênica. (B) Ilustração da artéria torácica interna esquerda e suas duas veias homônimas, com a sintopia em corte no plano transversal.
Fonte: Modificado de He GW5.
A retirada da artéria torácica interna pode ser pediculada, que similarmente à safena no touch envolve a obtenção do vaso com seu tecido perivascular, além do método esqueletizado. Este último possui, teoricamente, maior probabilidade de lesão traumática à retirada, porém os benefícios se dão através do comprimento extra de 5 a 7 centímetros em média, da possibilidade de anastomoses sequenciais, do maior fluxo sanguíneo que pode ser evidenciado no Doppler ao final das anastomoses e menor complicações na ferida operatória5,11.
Todos os pacientes devem receber, com raras exceções, ao menos um enxerto arterial, sendo de eleição a artéria torácica interna esquerda para revascularizar a artéria interventricular anterior11. Contudo, podemos utilizar concomitantemente a artéria torácica interna direita, método conhecido por “dupla mamária”, porém ao analisar o estudo ART (Arterial Revascularization Trial), que envolveu inicialmente 3102 pacientes para avaliar os desfechos entre a cirurgia por dupla ou única artéria torácica interna, não houve diferença estatística significativa quanto ao desfecho primário de morte em 10 anos (P = 0.62)12. Entretanto, o mesmo estudo apontou que 6 meses após a cirurgia, o grupo operado por “dupla mamária” apresentou mais complicações na ferida esternal que o grupo de única artéria torácica interna (n = 54; % = 3,5) e (n = 30; % = 1,9), respectivamente, além de maior necessidade de reconstrução esternal (n = 31; % = 2,0) e (n = 10; % = 0,6), respectivamente12. Mais ainda, dentre os 3102 envolvidos no estudo ART, foram selecionados 2056 pacientes para um trabalho derivado a fim de avaliar o número de complicações no osso esterno em um ano, indicando piores resultados para o grupo “dupla mamária” pediculada (n = 459), onde 74 pacientes (16,1%) foram acometidos e 7 (1,5%) necessitaram de reconstrução, havendo 12 óbitos (2,6%) no período de estudo13. Ainda neste trabalho, o grupo de única artéria torácica interna pediculada (n = 607) demonstrou que 58 pacientes (9,5%) apresentaram complicação na ferida esternal, 6 necessitaram de reconstrução (1,0%) e ao todo, 13 óbitos (2,1%); já o grupo “dupla mamária” esqueletizada (n = 478) abrangeu 46 pacientes (9,6%) acometidos, ocorrendo reconstrução em 10 (2,1%) e mortalidade de 15 (3,1%); por fim, no grupo de única artéria torácica interna esqueletizada (n = 512), 41 (8,0%) desenvolveram a ferida, sendo 12 (2,3%) pacientes submetidos à reconstrução esternal e 15 mortes (2,9%)13. O estudo concluiu que os resultados entre “dupla mamária” esqueletizada e única artéria torácica interna pediculada, sendo esta última o padrão de retirada, demonstraram complicações percentualmente similares, mas o método “dupla mamária esqueletizada” parece, em contrapartida, assegurar maior proteção em pacientes de alto risco para complicações (diabéticos insulino-dependentes, sexo feminino e pacientes com alta massa corpórea), enquanto o grupo única artéria torácica interna esqueletizada não promoveu benefício adicional quando comparado ao grupo única artéria torácica interna pediculada13.
Vale destaque na temática das artérias torácicas internas a contribuição do professor Luiz Boro Puig, que em 1983 iniciou a prática de revascularização com nova abordagem da artéria torácica interna direita esqueletizada, permitindo chegar à parede posterolateral do coração e assim alcançando ramos no ventrículo esquerdo como a artéria circunflexa, tudo isso valendo-se da passagem do enxerto através do seio transverso do pericárdio (Figura 5)14. Anteriormente à contribuição, o conduto se limitava a revascularizar ramos da artéria coronária direita e, fortuitamente, ramos da coronária esquerda na face esternocostal do coração14.

Figura 5. Ilustração da artéria torácica interna direita esqueletizada e retroaórtica através do seio transverso do pericárdio, possibilitando alcançar o ramo marginal obtuso da artéria circunflexa, uma contribuição brasileira.
Fonte: Puig LB et al14.
Apesar da artéria torácica interna esquerda para revascularização da artéria interventricular anterior ser o padrão-ouro, um trabalho abrangendo três hospitais do Japão avaliou a perviedade após “dupla-mamária” entre os enxertos e inicialmente envolveu 877 pacientes, sendo um grupo de 683 com a artéria torácica interna direita para a artéria interventricular anterior, ao passo que a esquerda foi destinada à outra coronária, enquanto os demais 194 pacientes compuseram o grupo que submetido à RM através da artéria torácica interna esquerda para a artéria interventricular anterior e, portanto, com a direita para outra coronária15. Utilizando a análise angiográfica e avaliando sem os escores de propensão, não houve diferença estatisticamente significativa entre as artérias para revascularizar a artéria interventricular anterior (P = 0.55), tendo em vista que as patências da artéria torácica interna direita em 1 e 2 anos foram 97,5% e 96,2%, respectivamente, enquanto da esquerda 99,0% e 95,8%, respectivamente15. Diferentemente, ao comparar as artérias torácicas internas quando direcionadas para coronárias distintas da interventricular anterior, a direita obteve resultado igual em 1 ano quando comparada à esquerda (96,7%), mas em 2 anos a patência foi de 93,5%, enquanto a esquerda obteve 94,0%, sendo a diferença progressivamente maior até a patência da direita ser significativamente inferior neste cenário em 6 anos (P = 0.038)15.
Ao utilizar escore de propensão para corrigir diferenças entre os grupos, a disparidade de patência entre os dois condutos para a artéria interventricular anterior em 6 anos foi estatisticamente significante em favor da artéria torácica interna direita (P = 0.046) e, da mesma forma, os resultados obtidos no mesmo período apontaram patência maior e significante em favor da revascularização da artéria torácica interna esquerda, comparada à homônima contralateral, para uma coronária distinta da interventricular anterior15. Em suma, o trabalho revelou melhores resultados com a artéria torácica interna direita para a artéria interventricular anterior e a esquerda para outra coronária (Figura 6), porém a pequena amostra, sobretudo no grupo da artéria torácica interna esquerda para a artéria interventricular anterior, o caráter retrospectivo e observacional, além de somente 50% dos pacientes haverem realizado cineangiocoronariografia após um ano de cirurgia, são limitações consideráveis e são necessários novos trabalhos e melhor desenhados15. Vale ressaltar que o estudo explicitou a vantagem da “dupla mamária” frente à torácica interna esquerda com a direita em “Y” por haver duas fontes supridoras independentes e todas as artérias torácicas internas foram esqueletizadas, com as cirurgias predominantemente sem auxílio da circulação extracorpórea (91%)15. Outra consideração ao citado trabalho é o “malabarismo” mental na interpretação de certos dados que não são facilmente explicitados e requerem maior tempo para interpretação.
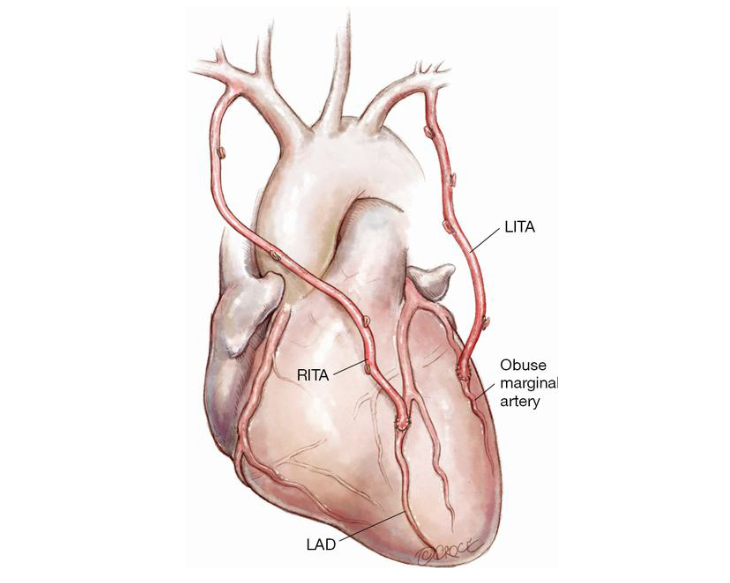
Figura 6. Revascularização do miocárdio com dupla mamária, com variante: a artéria torácica interna direita (RITA – Right Internal Thoracic Artery) para a artéria interventricular anterior (LAD – Left Anterior Descending) e artéria torácica interna esquerda (LITA – Left Internal Thoracic Artery) para o ramo marginal obtuso da artéria circunflexa na parede lateral do ventrículo esquerdo, como sugerem Ogawa S et al13.
Fonte: Taggart DP16.
ARTÉRIA RADIAL
A artéria radial é um dos ramos terminais da artéria braquial e tem início ao nível da prega do cotovelo para prosseguir no aspecto radial do antebraço até o punho6. Sua retirada completa junta ao seu pedículo (Figura 7A e B), além das injeções intraluminal e subadventícia de vasodilatadores, são úteis na prevenção de espasmos (Figura 7C), enquanto a obtenção via endoscópica é possível, contudo, carece de evidências relativas à segurança e eficiência11.
Vale ressaltar que a atual diretriz europeia ESC/EACTS de revascularização miocárdica (2018) desaconselha a utilização da artéria radial em três situações: quando recentemente utilizada para realização de cineangiocoronariografia, já que danos endoteliais consideráveis são possíveis, quando o teste de Allen for positivo, ou se houver calcificação degenerativa11. Possui classe I e nível B na indicação de escolha sobre a veia safena magna em pacientes com estenose coronariana grave, tendo em vista que efeitos adversos ocorrem na artéria radial quando a estenose coronariana é inferior a 70%, reduzindo sua patência, porém é recomendada quando a estenose for acima de 70% e, idealmente, quando superior a 90%11. Portanto, a artéria radial é melhor indicada como segundo enxerto arterial quando a revascularização por “dupla mamária” não for exequível, também quando houver alto risco de complicações em ferida esternal caso fossem utilizadas as artérias torácicas internas, ou como terceiro enxerto arterial de eleição11.
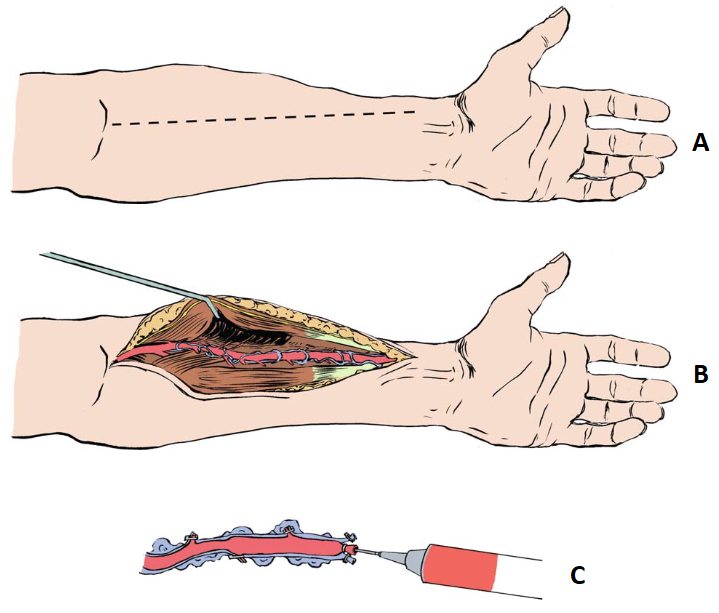
Figura 7. (A) Linha de incisão no antebraço. (B) Visualização da artéria radial e suas veias satélites a partir da retração do músculo braquiorradial. (C) Artéria radial obtida com seus ramos ligados e sendo injetada solução contendo sangue heparinizado e papaverina.
Fonte: Modificado de He GW5.
Um trabalho envolvendo 50 pacientes revascularizados com os três principais enxertos foi realizado para identificar as diferentes patências dos vasos em 10 anos, abarcando 196 anastomoses17. Todas as artérias torácicas internas foram as esquerdas e pediculadas (n = 62; % = 32), sendo 57 para a artéria interventricular anterior, 4 para a artéria circunflexa e 1 para a artéria coronária direita17. Dentre as artérias radiais, todas não-pediculadas (n = 77; % = 39), 8 foram dirigidas para a artéria interventricular anterior, 50 para a artéria circunflexa e 19 para a artéria coronária direita, enquanto as veias safenas magnas (n = 57; % = 29) foram obtidas através da técnica convencional, com 6 anastomoses para a artéria interventricular anterior, 18 para a artéria circunflexa e 33 para a artéria coronária direita17. O estudo se baseou na avaliação angiográfica dos enxertos e a análise primária das anastomoses referente ao lúmen, podendo ser classificados em “irregulares” ou “regulares”, os primeiros quando houvesse qualquer irregularidade e por menor que fosse, enquanto os últimos, quando o lúmen fosse normal ao exame e neste caso, se ao mesmo tempo patente, descritos como “perfeitamente patentes”17. Por outro lado, a análise secundária levava em conta a patência do enxerto mesmo na presença de irregularidade luminal, divididos em “patentes” e “ocluídos”, além de considerar as anastomoses sequenciais como enxertos distintos17.
Os resultados de patência perfeita foram de 96,8% entre as artérias torácicas internas esquerdas, 92,2% nas artérias radiais e 17,5% em veias safenas magnas convencionais, indicando alta incidência de aterosclerose nas veias17. Nesta análise primária, o grupo das artérias torácicas internas esquerdas não obteve diferença significante quando comparado ao grupo das radiais, sendo de 4,6% a diferença absoluta (P = 0.265), porém de 79,3% (P < 0.001) em relação às veias17. Da mesma forma, as artérias radias também obtiveram superioridade em patência perfeita quando comparadas às veias safenas, denotada pela diferença absoluta de 74,7% (P < 0.001)17. Similarmente à ordem da análise primária, a secundária revelou patência das artérias torácicas internas esquerdas pediculadas, artérias radiais não-pediculadas e veias safenas convencionais de respectivamente 96,8%, 93,5% e 82,5%17. A fragilidade do estudo se dá em não haver empregado veias safenas pela técnica no touch, estas notadamente superiores em termos de patência se comparadas às obtidas de forma convencional, o que inegavelmente culminou em piores resultados aos demais enxertos analisados e não nos deu parâmetro avaliativo do segundo enxerto de escolha entre aquela e a artéria radial, urgindo novos estudos que comparem os enxertos em pé de igualdade.
Em relação a qual enxerto utilizar, fica clara a resposta individualizada ao questionamento graças às múltiplas facetas apresentadas nos diferentes cenários, exigindo a atualização e estudo constantes dos cirurgiões e cirurgiãs cardiovasculares acerca dos enxertos e patências em diferentes cenários e métodos, além da expertise na correta obtenção e anastomose dos enxertos, além do fomento a novas pesquisas com estudos bem desenhados e acompanhados, descritivos e portanto, esclarecedores.
Referências
1. Rocha EAV. Fifty years of coronary artery by-pass graft surgery. Braz J Cardiovasc Surg. 2017;.32(4):II-III. doi: 10.21470/1678-9741-2017-0104.
2. Konstantinov IE. The first coronary artery bypass operation and forgotten pioneers. Ann Thorac Surg. 1997;64:1517-1528.
3. Kolessov VI. Mammary artery-coronary artery anastomosis as method of treatment for angina pectoris. J Thorac Cardiovasc Surg. 1967;54(4):535-544.
4. Jones DS. CABG at 50 (or 107?) – the complex course of therapeutic innovation. N Engl J Med. 2017;376(19):1809-1811. doi: doi:10.1056/NEJMp1702718.
5. He GW. Arterial grafts for coronary bypass surgery. 2. ed. Singapore: Springer-Verlag Ltd; 2006. doi:10.1007/3-540-30084-8.
6. Goss CM. Gray Anatomia. 29. ed. Rio de Janeiro: Guanabara Koogan; 1988.
7. Barbosa Filho ACA. Entrevista com Dr. Domingos Souza: pai da safena no touch / Interview with MD. Domingos Souza: father of no touch saphenous vein, Braz J Cardiovasc Surg Blog. 2019. Disponível em: https://blog.bjcvs.org/single-post/2020/02/06/entrevista-com-dr-domingos-souza-pai-da-safena-no-touch-interview-with-md-domingos-souza-father-of-no-touch-saphenous-vein/
8. Papakonstantinou NA, Baikoussis NG, Goudevenos J, Papadopoulos G, Apostolakis E. Novel no touch technique of saphenous vein harvesting: Is great graft patency rate provided?. Ann Card Anaesth 2016;19:481-488.
9. Samano N, Geijer H, Liden M, Fremes S, Bodin L, Souza D. The no-touch saphenous vein for coronary artery bypass grafting maintains a patency, after 16 years, comparable to the left internal thoracic artery: a randomized trial. J Thorac Cardiovasc Surg. 2015;150(4):880-888. doi:10.1016/j.jtcvs.2015.07.027.
10. Samano N, Souza D, Pinheiro BB, Kopjar T, Dashwood M. Twenty-five years of no-touch saphenous vein harvesting for coronary artery bypass grafting: structural observations and impact on graft performance. Braz J Cardiovasc Surg. 2020;35(1):91-99.
11. Neumann FJ, Sousa-Uva M, Ahlsson A, Alfonso F, Banning AP, Benedetto U, et al. 2018 ESC/EACTS guidelines on myocardial revascularization. Eur Heart J. 2019;40(2):132. doi:10.1093/eurheartj/ehy394.
12. Taggart DP, Benedetto U, Gerry S, Altman DG, Gray AM, Lees B, et al. Bilateral versus single internal-thoracic-artery grafts at 10 years. N Engl J Med. 2019;380:437-446. doi:10.1056/NEJMoa1808783
13. Benedetto U, Altman DG, Gerry S, Gray A, Lees B, Pawlaczyk R, Flather M, Taggart DP; Arterial Revascularization Trial Investigators. Pedicled and skeletonized single and bilateral internal thoracic artery grafts and the incidence of sternal wound complications: Insights from the Arterial Revascularization Trial. J Thorac Cardiovasc Surg 2016;152:270–276.
14. Puig LB, França Neto L, Rati M, Ramires JAF, Luz PL, Pileggi F, et al. A technique of anastomosis of the right internal mammary artery to the circumflex artery and its branches. Ann Thorac Surg. 1984;38(5):533-534.
15. Ogawa S, Tsunekawa T, Hosoba S, Goto Y, Kato T, Kitamura H, et al. Bilateral internal thoracic artery grafting: propensity analysis of the left internal thoracic artery versus the right internal thoracic artery as a bypass graft to the left anterior descending artery. Eur J Cardiothorac Surg. 2019. doi:10.1093/ejcts/ezz290 .
16. Taggart D P. How I deploy arterial grafts. Ann Cardiothorac Surg. 2018;7(5):690-697. Disponível em: http://www.annalscts.com/article/view/16534/16789.
17. Royse A, Pamment W, Pawanis Z, Clarke-Errey S, Eccleston D, Ajani A, et al. Patency of conduits in patients who received internal mammary artery, radial artery and saphenous vein grafts. BMC Cardiovasc Disord. 2020. doi:10.1186/s12872-020-01433-0.