Desde o primeiro relato em 2002, o implante transcateter de valva aórtica (TAVI) tem sido selecionada e, em alguns casos, considerada a opção à cirurgia de troca valvar aórtica (TVA). Uma alternativa disponível, menos invasiva e segura para pacientes idosos com estenose aórtica grave [1]. A TAVI é considerada para pacientes categorizados como alto risco para a cirurgia convencional e aceita como a opção viável para aqueles inoperáveis [2]. Recentemente, muitos estudos vêm demonstrando a não inferioridade em curto prazo em relação a cirurgia convencional em pacientes de risco intermediário [3,4]. De acordo com a diretriz para Doenças Cardíacas Valvares da American Heart Association e o American College of Cardiology a TAVI tem classe de recomendação I em pacientes de alto risco e classe IIa para aqueles de risco cirúrgico intermediário [5].
Apesar dos benefícios iniciais, muitos questionamentos ainda devem ser respondidos a fim de comprovar sua real segurança e viabilidade, especialmente em pacientes de moderado e baixo risco cirúrgico, incluindo a durabilidade em longo prazo da prótese, a sobrevida em longo prazo do paciente, o vazamento paravalvar e suas consequências , a melhor abordagem para aqueles sem acesso transfemoral, a concomitância com doença arterial coronariana, o índice de distúrbios de ritmos e necessidade de implante de marcapasso, ou outra doença valvar e a formação de trombos.
Por outro lado, comparado a cirurgia de troca valvar aórtica a TAVI não é um procedimento livre de complicações, e vem sendo associada a maiores taxas de anormalidades do ritmo cardíaco e a necessidade de implante de marcapasso permanente após o procedimento [6]. Neste cenário, tendo em mente que a indicação de TAVI está se expandindo para pacientes mais jovens e com menor risco cirúrgico, é importante entender as características do paciente e do procedimento associadas ao implante de marcapasso pós-TAVI.
A frequência de implante de marcapasso permanente no pós-operatório é estimada entre 8 a 40% versus 3–12 % na cirurgia de troca valvar aórtica convencional, com frequência respectivamente de 21.6% vs. 7.5%, OR 7.4, 95% IC 1.98 – 8.34; p<0.001 em pacientes de baixo a intermediário risco [7-9]. A influência de fatores para essa variabilidade ainda não foi elucidada, porém, as evidências sugerem que algumas condições elétricas, anatômicas e intrínsecas ao procedimento podem explicar esses achados.
Salienta-se que há enorme variação quando se compara o emprego de próteses de gerações mais iniciais com as de nova geração, especificadas na Figura 1 [9]. Estudos apontam preditores independentes para o implante incluindo, em geral, a existência de bloqueios de ramos (bloqueio de ramo direito, tem sido enfatizado que é um dos mais influentes) ou bloqueio atrioventricular no pré-operatório e a duração do complexo QRS após o procedimento, a presença de aorta em porcelana, ausência de cirurgia valvar prévia, o grau de calcificação, localização e tamanho do anel aórtico, profundidade do implante, dilatação aórtica por balão e grau de “oversizing” e a escolha da prótese [10-13].
Figura 1 Early- e new-generation transcatheter aortic valves: (A) SAPIEN Edwards, (B) SAPIEN XT, (C) Medtronic CoreValve, (D) SAPIEN 3, (E) CoreValve Evolut R, (F) ACURATE transcatheter heart valve system, (G) Lotus valve, (H) Direct Flow Medical Transcatheter Aortic Valve System, (I) JenaValve, and (J) Portico. THV, transcatheter heart valve
Disponível em: Rosendael PJV, Delgado V, Bax JJ. Pacemaker implantation rate after transcatheter aortic valve implantation with early and new-generation devices: a systematic review. European Heart Journal. 2018;39(21):2003–13.
A fim de facilitar a compreensão dos estudos disponíveis, Van Rosendael et al. em 2018 publicaram uma revisão sistemática com 40 estudos (n = 17 139), entre os quais estão o PARTNER II, REPRISE II trial, DISCOVER study, SURTAVI trial, PARTNER EU trial, CHOICE trial [14]. A incidência de implante de marcapasso variou drasticamente a depender do tipo de valva utilizada obtendo, por exemplo, uma frequência de 2.3% a 36.1% com próteses de nova geração. Para próteses balão-expansível, essa taxa foi menor usando a SAPIEN (2.3% a 28.2%) comparado a SAPIEN 3 4.0% a 24.0%. Quando se faz uma análise por estudos, no PARTNER e PARTNER 2B (alto risco e inoperáveis), a taxa de implante foi de 7% (Sapien/Sapien XT), aumentando para 8.5% (Sapien XT valve) no posterior PARTNER 2A [15]. Na Sapien 3, apesar de diminuir o vazamento paravalvar, teve aumento no implante de marcapasso, com 13% nos riscos intermediários e alto risco. Para as autoexpansíveis, as taxas foram maiores na CoreValve (16.3–37.7%), com relativa redução com a Evolut R (14.7–26.7%) [14].
No que se refere a comparação entre as próteses de nova geração, na figura 2, pode ser visto o histograma com a incidência de implante de marcapasso permanente após TAVI:
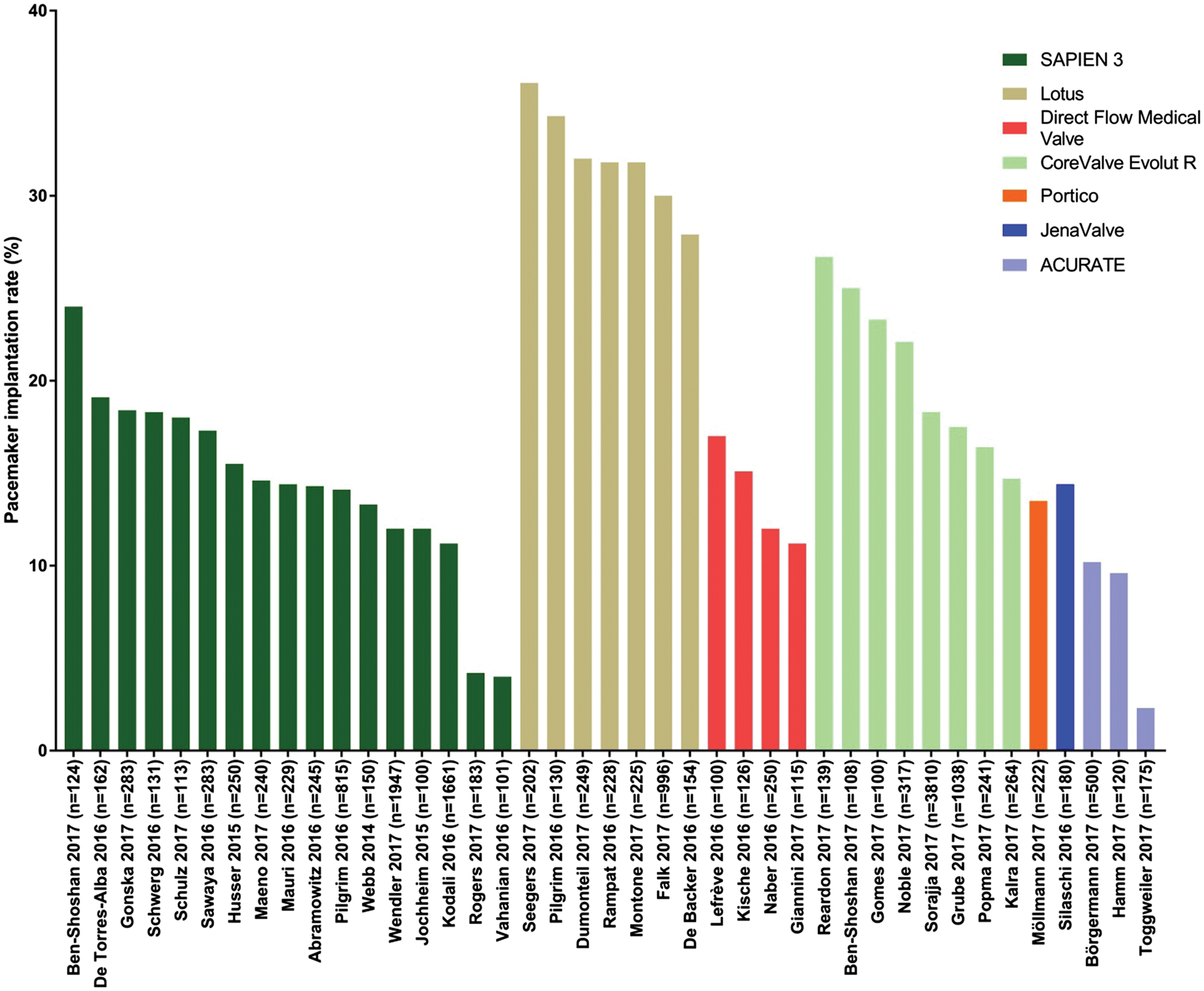
Figura 2: Histograma mostrando a incidência de implante de marcapasso permanente pós transcatheter aortic valve implantation com próteses de nova geração
Disponível em: Rosendael PJV, Delgado V, Bax JJ. Pacemaker implantation rate after transcatheter aortic valve implantation with early and new-generation devices: a systematic review. European Heart Journal. 2018;39(21):2003–13.
Os mecanismos pelos quais ocorre a lesão do Sistema de condução durante a TAVI ainda não foi esclarecido, no entanto, sabe-se que há a lesão mecânica pela prótese da exclusão da valva nativa e, desta forma, a relação anatômica da valva aórtica, bem como a técnica para o implante das diferentes próteses favorecem a ocorrência de arritmias.
A valva aórtica está intimamente relacionada com o nó atrioventricular (nó AV) e o ramo esquerdo do feixe de His, conforme pode ser visto na figura 3. O nó AV está localizado no átrio direito, no ápice do triangulo de Koch, em proximidade com o folheto septal da valva tricúspide e o septo interventricular, em continuidade com as cúspides da valva aórtica. Em um nível inferior, a via de saída do ventrículo esquerdo relaciona-se com o ramo esquerdo do feixe de His. Assim, trauma mecânico direto ou compressão do nó AV ou do ramo esquerdo por dilatação por balão e no próprio implante da prótese pode causar bloqueio AV ou de ramo esquerdo durante ou após a TAVI.
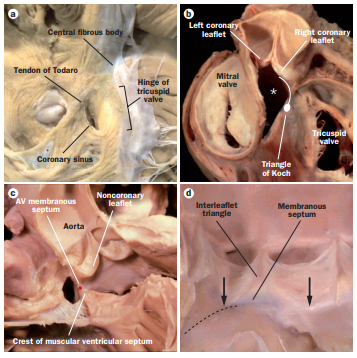
Figura 3: Anatomia e relação do complexo valvar aórtico e do Sistema de condução atrioventricular A) Visão do átrio direito em que se pode ver o triângulo de Koch. B) Remoção do folheto não coronariano, mostrando a relação do Nó atrioventricular com a valva. C) Posição do feixe de His entre o septo interventricular. D) Abertura da valva aórtica vista do ventrículo esquerdo. As inserções basais dos folhetos direito e não coronariano da válvula aórtica (setas), com a localização da parte mais superior do ramo esquerdo do feixe.
Fonte: van der Boon RM, Nuis RJ, Van Mieghem NM, et al. New conduction abnormalities after TAVI–frequency and causes. Nat Rev Cardiol. 2012;9(8):454-463. Published 2012 May 1.
Jilaihawi et al. fez a hipótese de que fatores como a natureza autoexpansível ou o formato da CoreValve, contrariamente à Edwards–Sapien, pode induzir uma compressão maior nas estruturas vizinhas ao anel aórtico [16]. Tanto o grau quanto a distribuição de calcificações da via de saída do ventrículo esquerdo estão associados a anormalidades do ritmo cardíaco pós TAVI. A assimetria da distribuição de cálcio pode resultar em uma expansão fora do plano valvar, no sentido mais oblíquo e, assim, a prótese agiria com estresse mecânico maior na região do sistema de condução.
A profundidade da penetração da prótese para a via de saída do ventrículo esquerdo determina a maior susceptibilidade para arritmias durante a TAVI, independentemente do tipo de valva utilizada. Portanto, utiliza-se um corte de até 6mm de distância média entre a margem anular do folheto não coronariano e a margem ventricular da prótese para predizer a necessidade de marcapasso, com sensibilidade de 89% e especificidade de 40% [17,18]. Ademais, uma vez que há relação entre o balão/ diâmetro do anel durante a dilatação com balão e o desenvolvimento de distúrbios de condução, dá-se a preferência pelo uso de balões cuja relação balão/ anel seja próximo a 1 ou balões 1-2 mm menor que o diâmetro do anel [19].
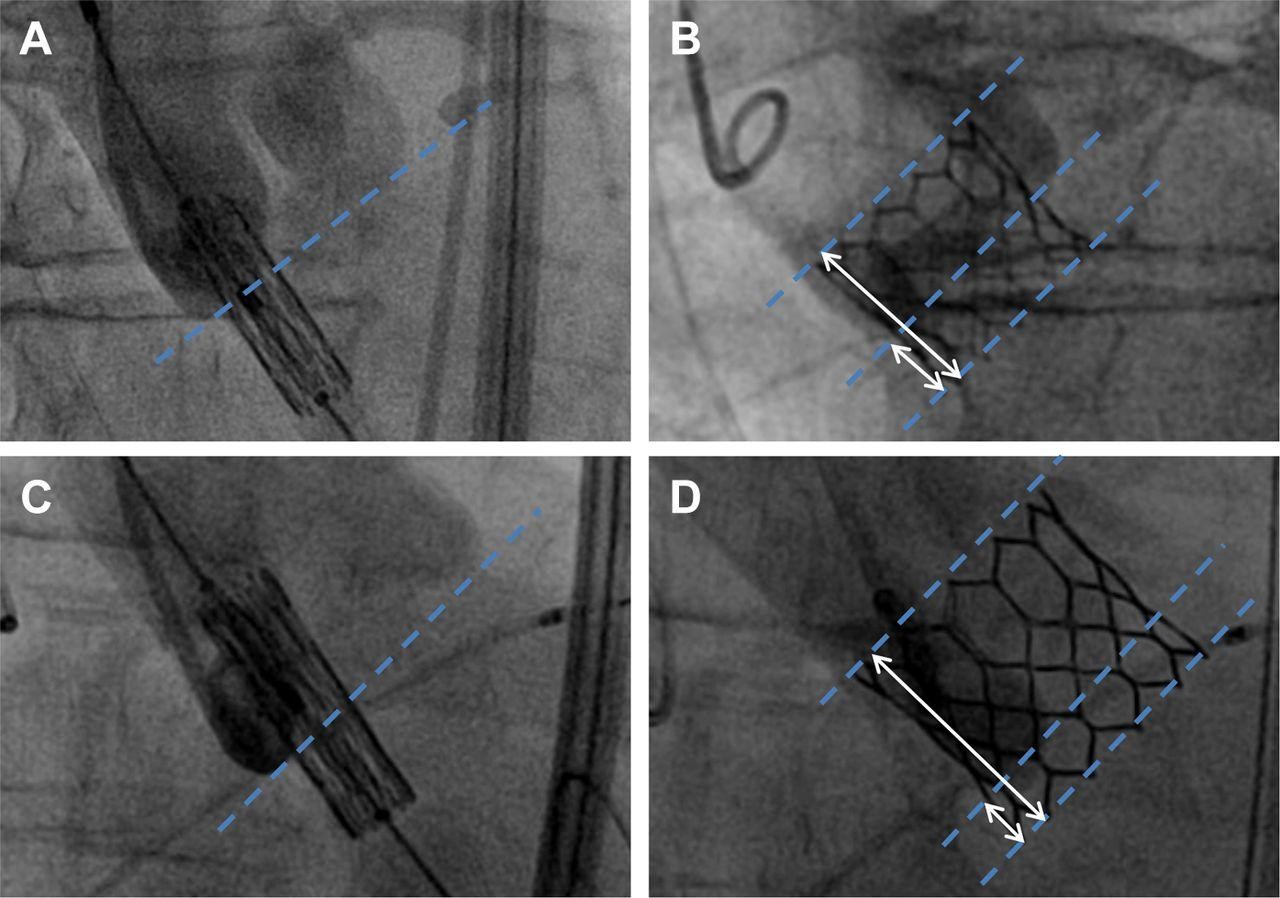
Figura 4: Profundidade de Implantação da prótese em dois cenários clínicos: (A,B) Implantação baixa e (C,D) implantação alta. Ilustrando a relação entre a entre a margem anular do folheto não coronariano e a margem ventricular da prótese
Fonte: Victor Mauri et al. JCIN 2016;9:2200-2209
As indicações para o implante de marcapasso permanente pós-TAVI seguem, em geral, as mesmas recomendações que pacientes não cirúrgicos [20]. No pós-TAVI, o manejo, em geral, é dependente do tipo de prótese implantada. Na ausência de bloqueios de alto grau no intraoperatório, a remoção precoce do marcapasso temporário aparentemente é seguro após o implante de Edwards Sapien, assim até a retirada, recomenda-se um monitoramento com eletrocardiograma de 12 derivações entre 24-48 horas. Para a CoreValve, recomenda-se um monitoramento de 48-72 horas antes da remoção do marcapasso temporário, mesmo que o ECG precoce pós-TAVI seja normal. Essas indicações são baseadas no fato de que uma proporção significativa de anormalidades de condução tem resolução autolimitada [21].
A diretriz da European Society of Cardiology recomenda que se espere um período de observação clínica de 7 dias até o implante do marcapasso permanente em BAVT ou BAV de alto grau, uma vez que ainda é difícil predizer se estes distúrbios serão permanentes ou transitórios.
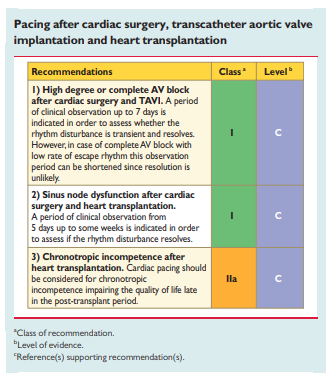
Figura 5: Recomendação de marcapasso após transcatheter aortic valve implantation (TAVI)
Disponível em: European Society of Cardiology (ESC)1; European Heart Rhythm Association (EHRA), Brignole M, Auricchio A, Baron-Esquivias G, Bordachar P, Boriani G, Breithardt OA, et al. 2013 ESC guidelines on cardiac pacing and cardiac resynchronization therapy: the task force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Europace. 2013;15(8):1070–118.
Portanto, tão importante quanto a indicação, é o tempo ideal para um implante seguro. Temos que considerar a dificuldade técnica intrínseca no implante imediato após a heparinização sistêmica, sob terapia dupla de antiagregação plaquetária, com aumento do risco de sangramento. No entanto, o adiamento para o implante prolonga a permanência com o marcapasso temporário, que também eleva as complicações, por exemplo, trombose do acesso venoso, perfuração cardíaca. Porém nenhuma das alternativas demonstrou superioridade na redução do risco de complicação [22].
Em seu segmento, o implante de marcapasso definitivo, seja em cirurgia de troca valvar, seja na TAVI, está longe de ser um procedimento inócuo, estando associado a um aumento de complicações, como aumento do tempo de permanência hospitalar e taxas de hospitalizações [23-25]. E seus riscos incluem hematoma, pneumotórax, infecção, endocardite, perfuração cardíaca [26]. Ainda, os efeitos a longo prazo sobre a função ventricular esquerda também devem ser analisados e o fato de uma futura troca do marcapasso expor o paciente a novas necessidades de abordagem e, subsequentemente, a outras complicações.
Em 2018, Ueshima et al. publicaram uma metanálise cujo objetivo foi analisar a influência do implante de marcapasso permanente sobre a mortalidade pós-TAVI [27]. Para tanto, com 28 estudos, dividiu os pacientes em 3 grupos: aqueles que haviam implante de marcapasso pré-TAVI; aqueles com implante de marcapasso permanente (implante em 30 dias pós-TAVI); aqueles sem implante de marcapasso (sem implante de marcapasso em até 30 dias pós-TAVI). Nos resultados, conforme pode ser visto na figura 6, verificou-se que pacientes que não necessitaram de implante de marcapasso tiveram menor mortalidade comparada com os outros grupos do estudo (risco relativo [RR] 0.76, 95%, intervalo de confiança [IC] 0.68-0.85, P < 0.0001), com média de seguimento de 16.3 meses. Em particular, o grupo com implante de marcapasso pré-TAVI (RR 1.43, 95% IC 1.26-1.62, P < 0.0001) teve uma mortalidade significativamente maior comparado ao grupo que não necessitou de marcapasso permanente. Já no grupo de pacientes com implante pós-TAVI não se notou diferença estatística (RR 1.08, 95% CI 0.99-1.18, P 5 0.10). Além disso, aqueles com marcapasso pré-TAVI tiveram mortalidade ainda maior quando o acesso para a TAVI foi transapical (P=0.03). No entanto, o estudo conclui que ainda há limitação para responder a complexa interação entre o tempo para o implante do marcapasso e a sua interação com os resultados da TAVI. Ainda, enfatiza que é necessário responder algumas perguntas quanto a interação da implantação do marcapasso nos resultados tardios.
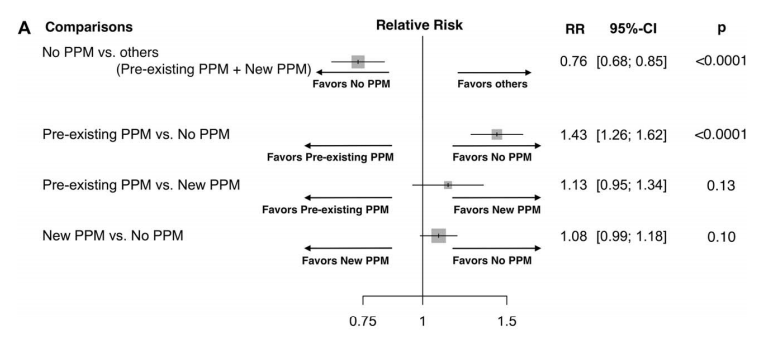
Figura 6: Forest plots das análises. A. Meta-análise do efeito na mortalidade a médio prazo de acordo com status de implante de marcapasso. PPM= permanent pacemaker, RR= Relative risk, CI= confidence interval.
Fonte: Ueshima D, Nai Fovino L, Mojoli M, Napodano M, Fraccaro C, Tarantini G. The interplay between permanent pacemaker implantation and mortality in patients treated by transcatheter aortic valve implantation: A systematic review and meta-analysis. Catheter Cardiovasc Interv. 2018;92(3):E159-E167.
Desta forma, é fato que os procedimentos transcateter são uma alternativa em ascensão e que não são isentos de complicações. Nota-se, pela diversidade dos estudos, que a população “TAVI” é heterogênea e que os procedimentos também devem ser individualizados, a depender dos seus inúmeros dispositivos tecnológicos. Portanto, este ainda é um campo em que predomina os questionamentos e há, infelizmente, poucas respostas. Estudos são necessários para se ter um melhor entendimento das anormalidades rítmicas causadas pela TAVI a fim de nortear tanto a seleção dos pacientes, o tempo de abordagem mais seguro e estabelecer critérios concretos para o manejo nesta situação.
Bibliografia
- Cribier A, Eltchaninoff H, Bash A, Borenstein N, Tron C, Bauer F, et al. Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis: first human case description. Circulation. 2002;106(24):3006-8
- Nishimura RA, Otto CM, Bonow RO, Carabello BA, Erwin JP III, Fleisher LA, Jneid H, Mack MJ, McLeod CJ, O’Gara PT, Rigolin VH, Sundt TM III, Thompson A. 2017 AHA/ACC focused update of the 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association task force on clinical practice guidelines. J Am Coll Cardiol 2017;70:252–258.
- Leon MB, Smith CR, Mack MJ, Makkar RR, Mumtaz M, Adams DH, et al. Transcatheter or surgical aortic-valve replacement in intermediate-risk patients. N Engl J Med. 2017;376(14):1321-31.
- Reardon MJ, Van Mieghem NM, Popma JJ, Kleiman NS, Søndergaard L, Mumtaz M, et al; SURTAVI Investigators. Surgical or transcatheter aortic-valve replacement in intermediate-risk patients. N Engl J Med. 2017;376(14):1321-31.
- Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Thorac Cardiovasc Surg 2014;148:e1-e132.
- Young Lee M, Chilakamarri Yeshwant S, Chava S, Lawrence Lustgarten D. Mechanisms of heart block after transcatheter aortic valve replacement – cardiac anatomy, clinical predictors and mechanical factors that contribute to permanent pacemaker implantation. Arrhythm Electrophysiol Rev. 2015;4(2):81-5.
- Terré JA, George I, Smith CR. Pros and cons of transcatheter aortic valve implantation (TAVI). Ann Cardiothorac Surg. 2017;6(5):444-452. doi:10.21037/acs.2017.09.15
- Bates MG, Matthews IG, Fazal IA, Turley AJ. Postoperative permanent pacemaker implantation in patients undergoing trans-catheter aortic valve implantation: what is the incidence and are there any predicting factors?. Interact Cardiovasc Thorac Surg. 2011;12(2):243-253.
- Becker M, Blangy H, Folliguet T, et al. Incidence, indications and predicting factors of permanent pacemaker implantation after transcatheter aortic valve implantation: A retrospective study. Arch Cardiovasc Dis. 2017;110(10):508-516. doi:10.1016/j.acvd.2017.03.004
- Fadahunsi OO, Olowoyeye A, Ukaigwe A, et al. Incidence, Predictors, and Outcomes of Permanent Pacemaker Implantation Following Transcatheter Aortic Valve Replacement: Analysis From the U.S. Society of Thoracic Surgeons/American College of Cardiology TVT Registry. JACC Cardiovasc Interv 2016;9:2189-99
- Munoz-Garcia AJ, Hernandez-Garcia JM, JimenezNavarro MF, et al. Factors predicting and having an impact on the need for a permanent pacemaker after CoreValve prosthesis implantation using the new Accutrak delivery catheter system. JACC Cardiovasc Interv 2012;5:533-9
- Calvi V, Conti S, Pruiti GP, et al. Incidence rate and predictors of permanent pacemaker implantation after transcatheter aortic valve implantation with self-expanding CoreValve prosthesis. J Interv Card Electrophysiol 2012;34:189-95.
- Waksman R, Steinvil A. Pre-Transcatheter Aortic Valve Replacement Right Bundle Branch Block: A Bundle of Trouble. JACC Cardiovasc Interv 2017;10:1575-7.
- van Rosendael PJ, Delgado V, Bax JJ. Pacemaker implantation rate after transcatheter aortic valve implantation with early and new-generation devices: a systematic review. Eur Heart J. 2018;39(21):2003-2013. doi:10.1093/eurheartj/ehx785
- Nazif TM, Dizon JM, Hahn RT, Xu K, Babaliaros V, Douglas PS, El-Chami MF, Herrmann HC, Mack M, Makkar RR, Miller DC, Pichard A, Tuzcu EM, Szeto WY, Webb JG, Moses JW, Smith CR, Williams MR, Leon MB, Kodali SK, Office PP. Predictors and clinical outcomes of permanent pacemaker implantation after transcatheter aortic valve replacement: the PARTNER (Placement of AoRtic TraNscathetER Valves) trial and registry. JACC Cardiovasc Interv 2015;8:60–69
- Jilaihawi H, Chakravarty T, Weiss RE, Fontana GP, Forrester J, Makkar RR. Meta-analysis of complications in aortic valve replacement: Comparison of Medtronic-Corevalve, Edwards-Sapien and surgical aortic valve replacement in 8,536 patients. Catheterization and Cardiovascular Interventions. 2012;80(1):128–38.
- Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Thorac Cardiovasc Surg 2014;148:e1-e132.
- Kammler J, Blessberger H, Fellner F, Kypta A, Lambert T, Engl M, et al. Implantation depth measured by 64-slice computed tomography is associated with permanent pacemaker requirement following transcatheter aortic valve implantation with the Core Valve® system. J Cardiol. 2016;67(6):513-8
- Nuis R, Van Mieghem NM, Schultz CJ, Tzikas A, Van der Boon RM, Maugenest AM, et al. Timing and potential mechanisms of new conduction abnormalities during the implantation of the Medtronic CoreValve System in patients with aortic stenosis. Eur Heart J. 2011;32(16):2067-74.
- European Society of Cardiology (ESC)1; European Heart Rhythm Association (EHRA), Brignole M, Auricchio A, Baron-Esquivias G, Bordachar P, Boriani G, Breithardt OA, et al. 2013 ESC guidelines on cardiac pacing and cardiac resynchronization therapy: the task force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Europace. 2013;15(8):1070–118.
- Fraccaro C, Napodano M, Tarantini G. Conduction disorders in the setting of transcatheter aortic valve implantation: a clinical perspective. Catheter Cardiovasc Interv. 2013;81(7):1217-23
- Biner S, Michowitz Y, Leshem-Rubinow E, Topilsky Y, Ben-Assa E, Shimiaie J, et al. Hemodynamic Impact and Outcome of Permanent Pacemaker Implantation Following Transcatheter Aortic Valve Implantation. The American Journal of Cardiology. 2014;113(1):132–7.
- Dizon JM, Nazif TM, Hess PL, et al. Chronic pacing and adverse outcomes after transcatheter aortic valve implantation. Heart 2015;101:1665-71.
- Elder DH, Lang CC, Choy AM. Pacing-induced heart disease: understanding the pathophysiology and improving outcomes. Expert Rev Cardiovasc Ther 2011;9:877-86.
- Wilkoff BL, Cook JR, Epstein AE, et al. Dual-chamber pacing or ventricular backup pacing in patients with an implantable defibrillator: the Dual Chamber and VVI Implantable Defibrillator (DAVID) Trial. JAMA 2002;288:3115-23
- Kotsakou M, Kioumis I, Lazaridis G, et al. Pacemaker insertion. Ann Transl Med 2015;3:42.
- Ueshima D, Nai Fovino L, Mojoli M, Napodano M, Fraccaro C, Tarantini G. The interplay between permanent pacemaker implantation and mortality in patients treated by transcatheter aortic valve implantation: A systematic review and meta-analysis. Catheter Cardiovasc Interv. 2018;92(3):E159-E167.