A raiz da aorta forma a via de saída do ventrículo esquerdo, iniciando ao nível das bases de cada válvula semilunar aórtica e findando ao nível da junção sinotubular, quando ocorre a transição para a aorta ascendente1. Esse segmento inicial é composto pelas válvulas semilunares aórticas, seios de Valsalva e triângulos intervalvulares, estes sendo expostos à hemodinâmica ventricular e provavelmente atuam permitindo independência na ação de cada seio, enquanto a inserção das válvulas cria um formato de coroa1. A despeito da ausência de uma estrutura similar a um anel como nas valvas atrioventriculares, a junção ventrículo-aórtica é comumente chamada de “anel aórtico” (Figura 1), mas não é este o único componente a ser ampliado em situações de desproporção prótese-paciente (DPP), nas quais a área efetiva do orifício indexada (AEOi) é ≤ 0,85 cm2/m2, e sim toda raiz aórtica, portanto melhor empregado o termo “ampliação da raiz aórtica” em detrimento do termo “anel”.
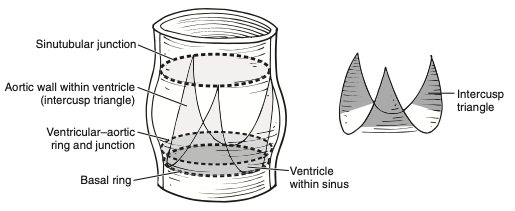
Figura 1. Delimitação da raiz aórtica, evidenciando o nível do chamado “anel aórtico”. A ilustração em separado traduz o formato de coroa do que seria o verdadeiro anel aórtico consequente da fixação das válvulas na parede aórtica.
Fonte: Kouchoukos et al.1.
Resumidamente, a DPP ocorre quando a área efetiva do orifício (AEO) da valva protética implantada (Figura 2) é muito pequena em comparação à área de superfície corporal (ASC) do paciente, cujo resultado hemodinâmico é a geração de gradientes muito elevados e aumento da mortalidade por qualquer causa e de causas cardiovasculares em longo prazo, apesar da prótese normofuncionante2,3. Para melhor compreensão, é necessário interpretar e extrair o que as equações traduzem aos cirurgiões, remediando uma DPP, por exemplo: a fórmula do gradiente pressórico transvalvar é igual a Q2/[k x AEO2], onde “Q” é o fluxo, “k” uma constante, e compreende-se que o gradiente pressórico é diretamente proporcional ao quadrado do fluxo, porquanto inversamente proporcional ao quadrado da AEO. Assim sendo, a AEO deve ser proporcional ao fluxo ideal e mantendo baixo gradiente transvalvar, didaticamente ilustrada em situação hipotética onde um paciente com índice cardíaco normal (parâmetro hemodinâmico a partir da divisão entre o débito cardíaco do ventrículo esquerdo e a ASC) de 3 l/min/m2 e ASC de 1,5 m2 recebe uma prótese valvar com 1,3 cm2 de AEO, culminando em gradiente transvalvar médio (GM) de 13 mmHg, enquanto se a mesma prótese for implantada em outro paciente com ASC de 2,5 m2, o GM se elevará até 35 mmHg, sendo essencial reforçar que tal diferença certamente se alargaria em situações de exercícios físicos, uma vez que o gradiente é diretamente proporcional ao quadrado do fluxo, que estaria elevado com o acréscimo da demanda metabólica.
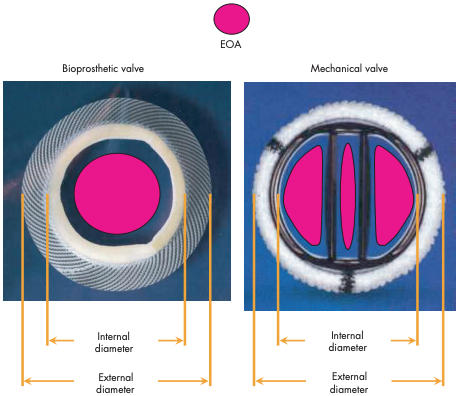
Figura 2. A AEO está ilustrada em rosa e a imagem da esquerda do leitor demonstra-a em prótese biológica, enquanto a imagem à direita a explicita em prótese mecânica bivalvulada. Portanto, a AEO se relaciona ao diâmetro interno protético, mas não ao externo, conhecimento inerente ao cirurgião.
Fonte: Pibarot P, Dumesnil JG2.
O parâmetro utilizado para determinar a DPP é a AEOi, obtida simplesmente a partir da fração entre a AEO e a ASC do paciente, correspondendo ao único parâmetro reiteradamente relacionado aos gradientes pós-operatórios2. Para tanto, o limite discriminatório para DPP em posição aórtica é uma AEOi ≤ 0,85 cm2/m2, sendo dividida entre DPP moderada, isto é, quando a AEOi estiver entre 0,65 a 0,85 cm2/m2 e DPP severa < 0,65 cm2/m2, uma classificação de suma importância, visto que no primeiro caso a prevalência da desproporção varia entre 20 a 70%, enquanto entre 2 a 11% no último caso2. Portanto, quando o cirurgião previamente calcular a AEOi de acordo com a prótese de determinada fabricante junto ao seu maior número possível em consonância à dimensão da raiz aórtica do paciente e o resultado corresponder à DPP em qualquer grau, a decisão diligente é expandir o horizonte e avaliar as opções em seu arsenal, como a utilização de outro tipo de prótese com uma AEO superior, a exemplo das biopróteses stentless, próteses mecânicas de nova geração ou até mesmo um homoenxerto2. Todavia, a ampliação da raiz aórtica com o tipo protético previamente planejado é exequível a fim de acomodar uma prótese de maior número, consequentemente maior AEOi, eliminando o risco de DPP2.
A ampliação da raiz aórtica é agir no presente e antecipar o futuro, posto que os pacientes jovens têm recebido próteses biológicas e diante do cenário atual, é de se esperar a necessidade de reimplante em algum momento, portanto certamente serão beneficiados futuramente com um implante de valva aórtica transcateter (TAVI) mais larga, frisando que as biopróteses atuais são dotadas de mecanismo que facilitam a fratura do anel protético e isso eleva em um número a prótese a ser implantada no procedimento de valva em valva (VIV)3. Ademais, a cirurgia e o procedimento transcateter não são excludentes, uma vez que o implante de TAVI em situação de DPP está associado ao dobro de mortalidade tardia e a ideia é que haja a ampliação para inserir a maior bioprótese possível3. Entretanto, os benefícios ainda não aparentam ser suficientes para encorajar sua implementação na rotina de muitos serviços, possivelmente por receio de um hipotético risco adicional de morbimortalidade4, imperando o benefício da dúvida por muito tempo, alimentado pela falta de estudos comparativos entre o implante de valva aórtica isolada ao implante combinado à ampliação da raiz aórtica. Esse cenário de pouca evidência e certa solidão vai de encontro à frase do saudoso professor Adib Jatene ao proferir que “o segredo é descobrir o jeito e pesquisa é descobrir o jeito”5.
Nesse sentido, Tam et al.4 recentemente publicaram um estudo coorte multicêntrico para responder as dúvidas quanto aos resultados imediatos e tardios da análise primária entre a cirurgia de substituição valvar aórtica (SVA) isolada versus SVA combinada à cirurgia de ampliação da raiz aórtica (ARA), resultando em 809 pares após escore de propensão baseado em 31 variáveis, bem como uma análise secundária da diferença entre a SVA concomitante à cirurgia de revascularização do miocárdio (RM) versus SVA + RM + ARA, gerando 525 pares após o mesmo escore de propensão4. A análise primária não mostrou diferença estatisticamente significativa de mortalidade entre SVA e SVA + ARA tanto em 30 dias (2,1% e 2,0%; P = 1), respectivamente, quanto em 8 anos (75,4% e 73,1%; P = 0,17), não havendo diferença significativa no tempo de internação hospitalar médio em dias (7 e 7; P = 0,95), no implante de marcapasso cardíaco (6,7% e 4,8%; P = 0,135), na reabertura do tórax (3,7% e 5,1%; P = 0,225) ou na reintervenção valvar aórtica em 8 anos após ajuste da variável “morte” como risco competitivo (3,7% e 3,6%; P = 0,77), diferentemente do tempo cirúrgico médio em minutos que foi estatisticamente significante (250 e 272; P < 0,001)4. Em relação à análise secundária comparando SVA + RM e SVA + RM + ARA, não existiu diferença significativa para mortalidade em 30 dias (3,0% e 3,6%; P = 0,731), respectivamente, bem como em 8 anos (59,8% e 57,3%; P = 0,88), além do estudo também não demonstrar diferença no tempo de internação hospitalar médio em dias (9 e 8; P = 0,72) ou no implante de marcapasso cardíaco (28 e 28; P = 1), contrariamente à reabertura do tórax (3,2% e 7,2%; P = 0,006) e ao tempo cirúrgico médio em minutos (303 e 325; P < 0,001), estatisticamente significantes4.
Em suma, o estudo concluiu que a ARA talvez seja uma ferramenta importante para facilitar o implante de próteses valvares mais largas, não sendo “talvez” uma colocação adequada ao analisar os resultados que foram muito similares entre os grupos, provando a segurança na ampliação da raiz e, mais ainda, que esses pacientes possivelmente seriam acometidos pela DPP e suas consequências deteriorantes caso não fosse realizada a ARA, realizada justamente por esse motivo. É provável que a principal fragilidade do estudo tenha sido não tabular qual a técnica utilizada em cada ARA (Figura 3), de valia para confrontar os resultados nos diferentes cenários de cada paciente, além da utilização de escores de propensão, com objetivo de investigar o desempenho das técnicas e se existe uma superior ou qual a melhor em cada particularidade, orientando estrategicamente o cirurgião de forma antecipada, sendo basilares novos estudos nessa linha de ideias.
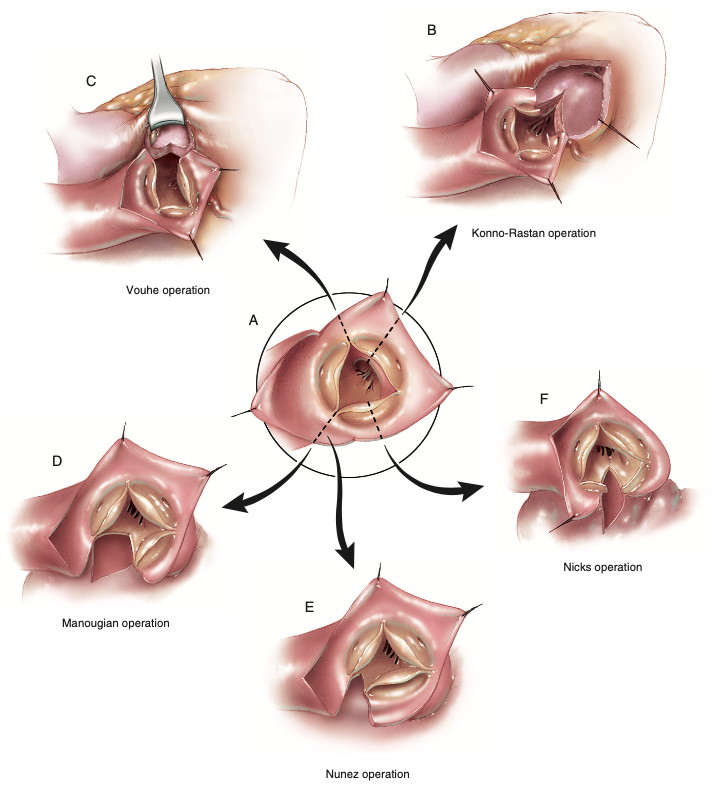
Figura 3. As diferentes técnicas ilustradas de ampliação da raiz aórtica. (A) As linhas de incisão através da raiz aórtica para cada técnica. (B) Técnica de Konno-Rastan. (C) Técnica de Vouhe. (D) Técnica de Manouguian. (E) Técnica de Nunez. (F) Técnica de Nicks.
Fonte: Doty D, Doty J6.
Dentre as estratégias no arsenal do cirurgião, é possível separá-las entre técnicas de ampliação posterior (Figura 3D-F) e de ampliação anterior (Figura 3B e C). As técnicas de Manouguian e de Nunez são consideradas mais anatômicas para ampliação da via de saída do ventrículo esquerdo, fato justificado através das incisões direcionadas sem alterar a anatomia normal dos componentes6.
Quando o cirurgião opta pela técnica de Manouguian (Figura 3D), é realizada uma incisão aórtica que percorre a comissura entre as válvulas semilunares posterior e esquerda da valva aórtica, seguindo caudalmente para atravessar o trígono intervalvular e o anel da valva mitral em um centímetro, ao meio de sua cúspide anterior, além de incisão posterior para abertura do teto atrial esquerdo (Figura 4A), adquirindo até 4 a 5 milímetros de diâmetro ampliado, superior ao que promete a técnica de Nunez6. A técnica de Manouguian é, portanto, melhor indicada quando uma ampliação maior da via de saída do ventrículo esquerdo for necessária, sendo o grau de alargamento diretamente proporcional à profundidade da incisão sobre a cúspide anterior da valva mitral6. Os aspectos técnicos de Manouguian incluem a utilização de patch que vedará a incisão desde a cúspide anterior da valva mitral até a região dividida da comissura, por meio de sutura com fio polipropileno 4-0 e preferencialmente através de pontos separados para assegurar mais força ao reparo do que a sutura contínua (Figura 4B)6. Ao atingir a região da abertura atrial esquerda, são realizadas suturas interrompidas que podem iniciar a partir de sua borda com fio 2-0 e almofada de Teflon, aproximando a prótese valvar ao patch protético (Figura 4C), concluída com sutura aplicada à aorta e aba restante do patch sob medida (Figura 4D)6.
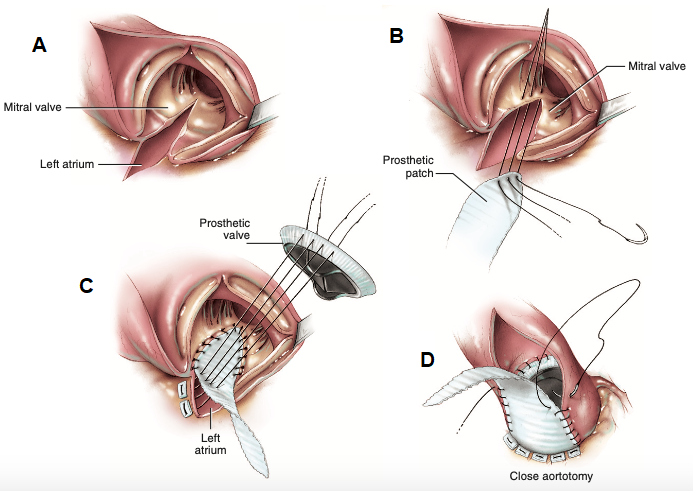
Figura 4. (A) Após a incisão na aorta, visualizadas as estruturas da raiz aórtica e concluída a incisão a partir da comissura entre as válvulas semilunares aórticas posterior e esquerda, perpassando o trígono intervalvular e a cúspide anterior da valva mitral, além da incisão no teto atrial esquerdo. (B) Os fios polipropileno 4-0 são passados desde a cúspide anterior da valva mitral até o patch protético de forma separada. (C) Fios 2-0 com almofada de Teflon são aplicados desde a borda da abertura atrial, perfurando o patch e então alcançando o anel da prótese valvar aórtica. (D) Fechamento da atriotomia e conclusão da técnica de Manouguian.
Fonte: Modificado de Doty D, Doty J6.
Enquanto isso, quatro anos após descrita a técnica de Manouguian, foi proposta a operação de Nunez (Figura 3E), cujos passos iniciais se assemelham aos de sua predecessora, com a incisão na aorta e extensão através da comissura entre as válvulas semilunares posterior e esquerda da valva aórtica até atingir o trígono intervalvular, sem prosseguir a partir deste ponto ou realizar atriotomia (Figura 5A)6. Assim, é notório que o diâmetro ampliado é menor do que a técnica anterior, agora de 2 a 3 milímetros6, e sabendo que cada milímetro ampliado é crucial para a adequada acomodação da prótese, a técnica de Nunez termina melhor indicada aos pacientes sem necessidade de larga ampliação da raiz aórtica, decisão individualizada ao perfil de cada paciente. A etapa seguinte é a passagem de fios 2-0 com almofada de Teflon e realizar suturas com pontos separados para ancoragem do patch à prótese valvar no plano da continuidade mitro-aórtica (Figura 5B) e o restante do anel protético é unido à via de saída do ventrículo esquerdo conforme preferência do cirurgião, seja com sutura contínua ou separada com pontos simples (Figura 5C), sucedida pelo fechamento da aortotomia utilizando o remanescente do patch e aplicando sutura contínua com fio de polipropileno 4-0 (Figura 5D)6.
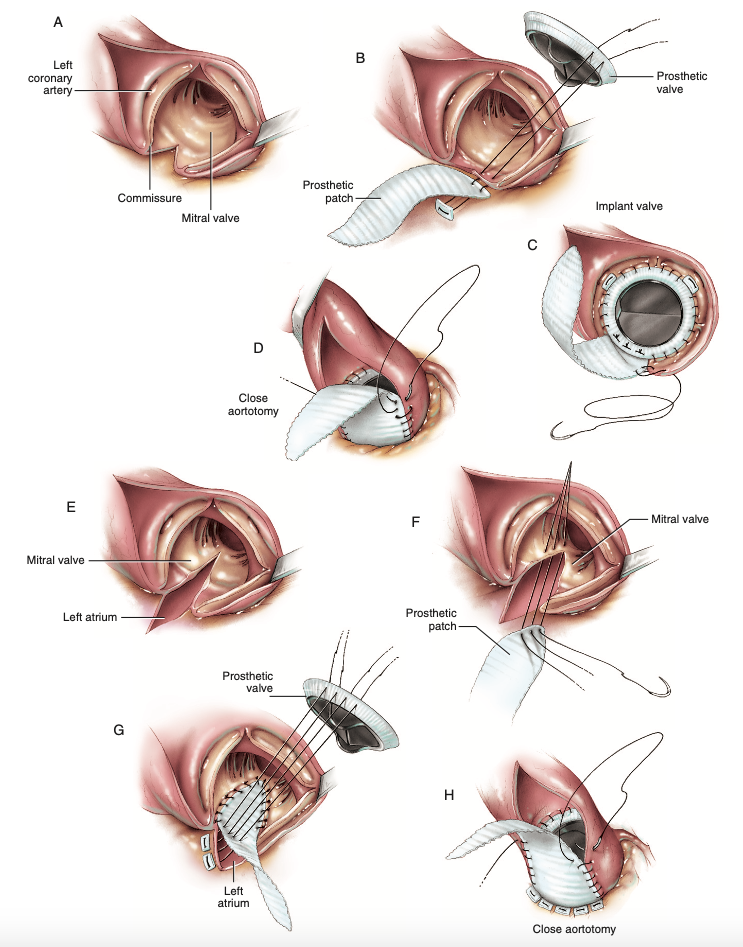
Figura 5. (A) Ilustração do aspecto visual após aortotomia e incisão na comissura em direção à cúspide mitral anterior. (B) Passagem dos fios 2-0 com almofada de Teflon na incisão, realizando suturas separadas. (C) Implante e sutura do restante do anel valvar protético. (D) Fechamento da aortotomia com sutura contínua e fio de polipropileno 4-0, finalizando a técnica de Nunez.
Fonte: Modificado de Doty D, Doty J6.
Ao optar a técnica de Nicks (Figura 3F), originalmente publicada através de uma série de 5 casos em 19707, é feita a aortotomia na porção ascendente a partir de incisão transversa estendida para o seio de Valsalva da válvula semilunar aórtica posterior (Figura 6A)6. Oposta à incisão da aorta, abre-se em seguida o átrio esquerdo lateralmente, gerando ótima visualização da cúspide anterior da valva mitral que pode ser amplamente seccionada até próximo de sua borda livre (Figura 6B), com separação e amplitude máximas da via de saída do ventrículo esquerdo, entre 2 a 4 milímetros6. Essa secção da cúspide mitral tem início descentralizado, uma vez que é realizada na válvula semilunar posterior, e não na comissura entre esta e a esquerda como nas técnicas de Manouguian e Nunez, portanto a incisão é então voltada para o meio da cúspide mitral anterior tão logo atinge o anel desta valva6. Em sequência, o patch é customizado de forma a adequar-se também à incisão na cúspide mitral e são unidos com fio polipropileno 4-0 em suturas separadas para reduzir a possibilidade de deiscência, porém também é admitido o uso de polipropileno 4-0 em sutura contínua (Figura 6C)6. O próximo passo é medir o anel aórtico e escolher a prótese aórtica compatível para realizar a passagem de fios com almofadas de Teflon desde a atriotomia esquerda em direção à face interna do patch e em seguida ao anel protético, culminando no fechamento atrial esquerdo relacionado ao seio de Valsalva posterior, na ancoragem da prótese e ainda na reconstrução da via de saída do ventrículo esquerdo (Figura 6D)6. A prótese valvar aórtica pode ter seu restante do anel suturado à raiz da aorta por sutura contínua ou a partir de pontos separados utilizando fios com almofadas de Teflon (Figura 6E) e assim é completada a cirurgia com o fechamento da incisão aórtica empregando fio de polipropileno 4-0 de forma contínua (Figura 6F)6.
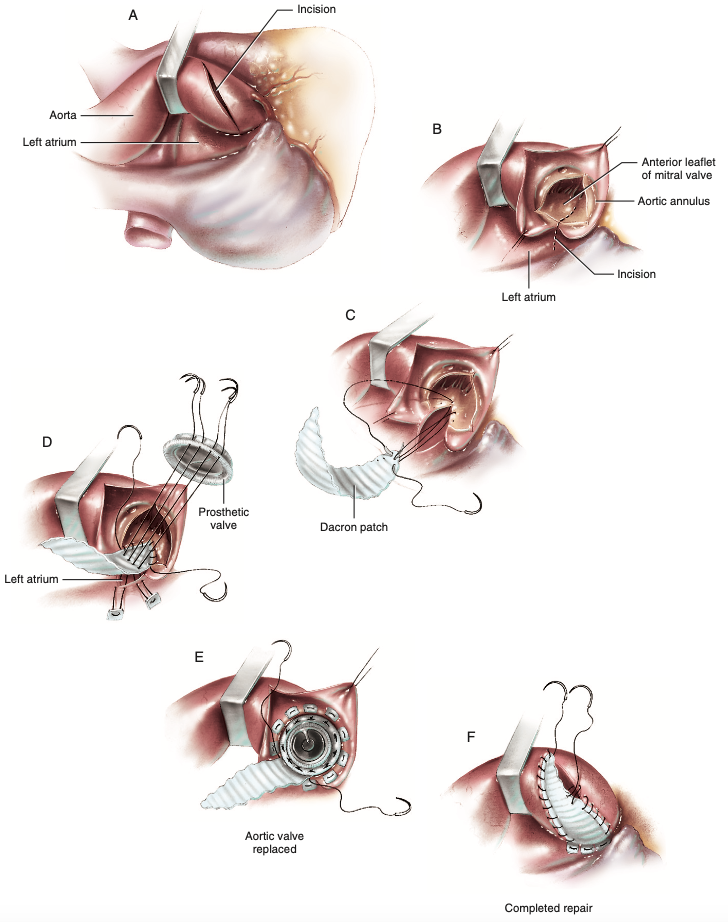
Figura 6. (A) Incisão transversa na aorta ascendente e direcionada ao seio de Valsalva posterior. (B) Realizada a abertura atrial esquerda e incisão na cúspide anterior da valva mitral. (C) Passagem de fios para união do patch customizado até a cúspide mitral. (D) Momento de medir a raiz aórtica para correto implante valvar e fechamento da atriotomia esquerda, passando fios contendo almofada de Teflon que perfuram o patch e então atingem a região relacionada do anel aórtico protético. (E) Sutura do restante da prótese. (F) Fechamento da aortotomia na técnica de Nicks.
Fonte: Doty D, Doty J6.
Reforçando que as técnicas anteriormente descritas (Manouguian, Nunez e Nicks) são classificadas como abordagens posteriores, resta detalhar as abordagens anteriores, iniciando com a técnica de Konno-Rastan (Figura 3B), que possui complexidade superior às abordagens posteriores devido ao maior risco de eventos indesejáveis como hemorragia, deiscência do patch, lesão do sistema de condução e insuficiência cardíaca esquerda6. Contudo, nesta técnica a via de saída do ventrículo esquerdo é amplamente alargada e a torna útil quando necessário mais de 2 a 4 milímetros de diâmetro, fruto que uma aortoventriculoplastia pode fornecer, geralmente indicada para crianças pequenas a fim de implantar uma prótese valvar aórtica congruente ao crescimento da criança, ao passo que posterga oportunamente o implante subsequente6.
Os pormenores técnicos iniciam pela dissecção da aorta, ventrículo direito e tronco da artéria pulmonar, até à esquerda da artéria coronária direita e ao anel aórtico, para só então realizar a aortotomia vertical (Figura 7A)6. Esta atravessa o seio de Valsalva direito bem próxima à comissura entre as válvulas semilunares direita e esquerda da valva aórtica, portanto distante da artéria coronária direita, enquanto o sistema de condução é protegido e a via de saída do ventrículo direito é exposta anteriormente adiante da incisão, sendo aberto o septo ventricular desde o anel aórtico em sentido anterior e esquerdo do feixe de His (Figura 7B)6,8. Logo após, são estendidas as aberturas da via de saída ventricular direita e do septo ventricular, alcançando a ampliação da via de saída do ventrículo esquerdo6. Para reconstrução desta via, lança-se mão de patch sob medida em forma de diamante que encerrará o septo ventricular com polipropileno 3-0 ou 4-0 em sutura contínua até o nível da valva aórtica, realizando passadas profundas no septo, visando maior segurança do fechamento (Figura 7C)6. Prontamente é realizada a medição do diâmetro da raiz aórtica na região em que a prótese valvar correta será acomodada, momento em que esta atua conjuntamente ao remanescente do patch anterior e a um segundo, triangular sob medida que será o novo teto da via de saída do ventrículo direito, realizando para isso a passagem de fios com almofadas de Teflon desde o último patch, atravessando o inicial e finalmente passados no anel valvar protético dessa região (Figura 7D)6. Para ancoragem da valva são feitos pontos separados aplicando fios com almofadas de Teflon, ou sutura contínua caso haja resistência adequada (Figura 7E)6.
A etapa final de Konno-Rastan (Figura 7F) abarca a sutura da via de saída do ventrículo direito com sutura contínua de polipropileno 4-0, sendo necessário comprimento suficiente do patch triangular para gerar uma anatomia que respeite o contorno dessa região, pois distorções são possíveis e requerem a atenção de quem opera, além do cuidado indispensável no começo da sutura na região do anel aórtico contínua ao ventrículo direito, pois este é o segmento mais frágil de toda técnica e a hemorragia oriunda dessa porção é gravíssima6. A raiz da aorta e aortotomia são encobertas com o patch inicial correspondente a partir de sutura contínua com polipropileno 4-0, sendo admissível o uso de cola biológica ao promover mais segurança com a redução de hemorragia das múltiplas fendas resultantes da sutura6.
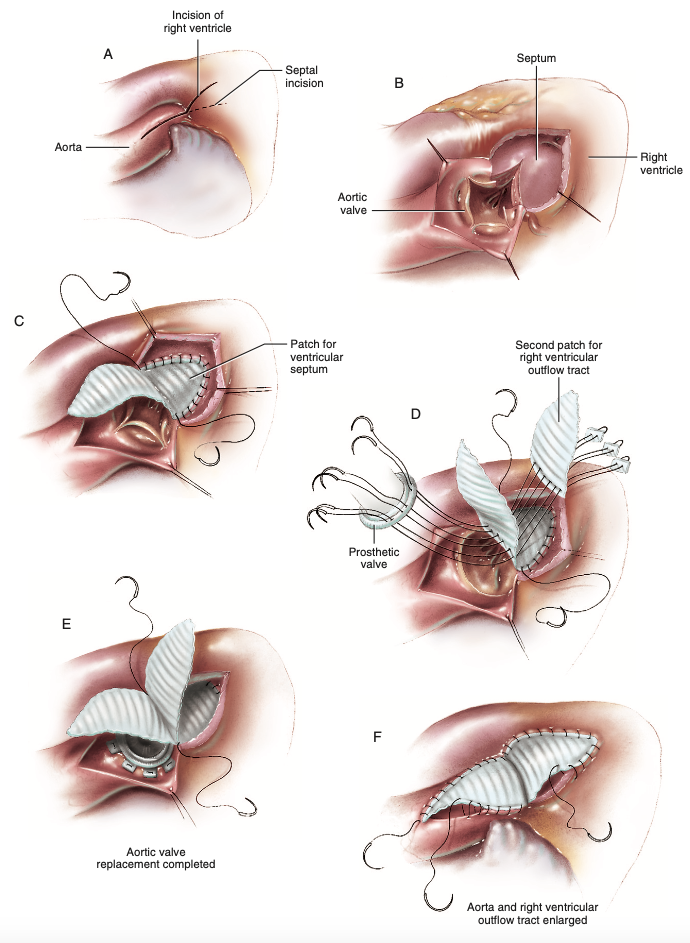
Figura 7. (A) Linhas ilustrativas demonstram os locais de incisão na aorta ascendente, raiz da aorta e ventrículo direito, após dissecção das estruturas adjacentes. (B) Incisão no seio de Valsalva direito, perpassando o septo infundibular e ampla via de saída ventricular esquerda é formada. (C) Reconstrução do teto da via de saída do ventrículo esquerdo, recriando o septo infundibular, agora mais amplo, passando fio de polipropileno 3-0 ou 4-0 em sutura contínua. (D) A mensuração do diâmetro na raiz da aorta precede a passagem de fios com almofadas de Teflon em pontos separados desde o segundo patch até o preexistente e em seguida ao anel protético. (E) Sutura do anel protético restante. (F) Síntese do patch primário e do triangular à aorta ascendente e à via de saída do ventrículo direito, respectivamente, concluindo a técnica de Konno-Rastan.
Fonte: Doty D, Doty J6.
A outra abordagem anterior disponível é a técnica de Vouhe (Figura 3C), também uma aortoventriculoplastia lançada quando ampliação maior que 2 a 4 milímetros for necessária, a exemplo das crianças pequenas6. Existe o cenário de obstrução da via de saída do ventrículo esquerdo totalmente subvalvar, enquanto a valva aórtica é normal ou passível de plastia, o qual a técnica de Vouhe é exequível por preservar a valva nativa e naturalmente protege o sistema de condução, graças à abertura no septo infundibular6.
O pontapé dessa estratégia é dissecar as grandes artérias e o ventrículo direito, identificando as fibras do septo infundibular e então voltando o olhar à aorta para efetuar sua abertura oblíqua, momento cujo estudo morfológico da valva aórtica é conduzido e a incisão é prolongada à comissura e trígono entre as válvulas semilunares aórticas esquerda e direita6. Prosseguindo, incisão transversa é feita na via de saída do ventrículo direito e o septo infundibular é revelado ao estender a abertura aórtica até a da cavidade ventricular direita e ao ventrículo esquerdo subjacente (Figura 8A)6. O espessamento do septo ventricular hipertrofiado é reduzido ao liberar sua superfície voltada ao ventrículo esquerdo, atenuando a obstrução da via de saída desta câmara e, caso essa medida seja suficiente para resolução e a valva aórtica possuir morfologia normal, é conduzida a correção através de sutura contínua ou separada desde o septo ventricular, ascendendo à comissura aórtica (Figura 8B) quando, por fim, fecha-se a abertura do ventrículo direito com suturas separadas e o encerramento da aortotomia segue com o mesmo fio que uniu o septo ventricular até a comissura valvar aórtica (Figura 8C)6.
Em situações onde a obstrução da via de saída do ventrículo esquerdo inclui a valva aórtica ou quando esta sofreu dano irreversível pelo fluxo turbulento crônico, ou se não houve ampliação suficiente após a septotomia, coloca-se um patch sob medida em forma de diamante para recriar a via de saída, enquanto o septo é fechado com passadas profundas da agulha de sutura na região, proporcionando mais segurança, e de maneira contínua com polipropileno 3-0 ou 4-0 até o nível do anel aórtico (Figura 8D)6. A medição do diâmetro na raiz da aorta é executada e a prótese de tamanho correto é escolhida, ao passo que um segundo patch em formato triangular é confeccionado para recobrir a via de saída do ventrículo direito e fios com almofadas de Teflon são passados como suturas separadas para unir o último patch ao primeiro, seguindo a sutura ao longo da valva protética nessa região, sendo unido o restante a partir de suturas com almofadas de Teflon e pontos separados ou com sutura contínua caso o anel possua resistência satisfatória6. O patch triangular é unido às bordas do ventrículo direito, assim a via de saída do ventrículo direito é restabelecida e o remanescente do patch inicial se presta à oclusão da aortotomia, ambas as suturas de maneira contínua e com fios de polipropileno 4-0, completando a correção (Figura 8E)6. Bem como na técnica de Konno-Rastan, pode ser utilizada a cola biológica com a mesma finalidade6.
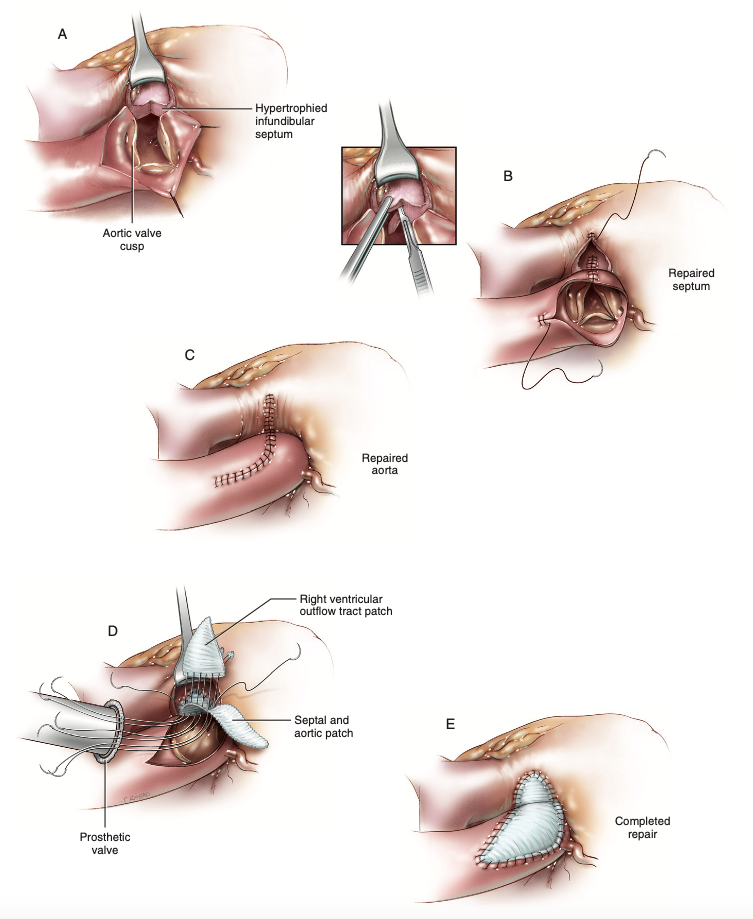
Figura 8. (A) Após dissecção no entorno das estruturas a serem abordadas, é realizada a aortotomia de maneira oblíqua, momento em que a morfologia valvar aórtica é estudada e em sequência a comissura entre as válvulas semilunares aórticas direita e esquerda é cortada e a via de saída do ventrículo direito é aberta para prosseguir a incisão até o septo infundibular. (B) Realiza-se incisão na superfície do septo infundibular hipertrófico em sua face voltada ao ventrículo esquerdo e, havendo alívio da constrição com valva nativa normal, o septo ventricular é fechado com sutura contínua até a comissura aórtica. (C) O fechamento do teto da via de saída ventricular direita é obtido com novo fio em sutura contínua, enquanto a aortotomia é concluída com o mesmo fio que encerrou o septo infundibular até a comissura. (D) Em situações que a valva aórtica está acometida, a via de saída do ventrículo esquerdo é ampliada, implantando um patch em formato de diamante, além de um segundo patch em formato de triângulo para recobrir e alargar a via de saída do ventrículo direito, com implante da prótese adequada. (E) Ilustração do aspecto final das suturas superficiais através da técnica de Vouhe.
Fonte: Doty D, Doty J6.
Até momento, diversas diretrizes de valvopatias não contemplam a temática de ARA, possivelmente reflexo da escassez de estudos do assunto, que dificulta a disseminação das técnicas e utilização na rotina dos serviços de cirurgia cardiovascular, a despeito do papel crucial que desempenha ao prevenir complicações catastróficas, senão fatais. Ademais, urge a necessidade de novos estudos na área, sobretudo prospectivos e bem desenhados, comparando o desempenho de cada técnica nas diferentes condições dos pacientes para guiar ainda melhor a escolha do cirurgião. O fato é que os estudos mostram a validade do método e provavelmente os pacientes submetidos à ARA possuíram resultados similares aos pacientes com SVA sem ampliação, em decorrência do cumprimento preventivo à DPP, além da ARA mostrar segurança em mãos experientes. O treinamento da equipe de cirurgiões e dos residentes é fundamental para implementação de rotina com segurança, além do incentivo de pesquisa para os acadêmicos de medicina com interesse no estudo da cirurgia cardiovascular. É imprescindível a análise das técnicas para correto julgamento da escolha após a avaliação criteriosa do perfil de cada paciente, com o que se tem até hoje disponível na literatura. A realização de eventos que estimulem a abordagem, promovendo debate do assunto e intercâmbio de conhecimentos e experiências através das sociedades regionais, seria de grande valia, inclusive o estímulo da temática e sua importância também presentes nas diversas ligas de cirurgia cardiovascular do país. Com o fomento à pesquisa, as respostas de longo prazo surgirão, mas até lá, o trabalho deve continuar – e isso significa livrar o paciente do implante de uma prótese normofuncionante que, ainda assim, causará malefícios desde o pós-operatório imediato.
Referências
1. Kouchoukos NT, Blackstone EH, Hanley FL, Kirklin JK, eds. Kirklin/Barratt-Boyes cardiac surgery. 4th ed. Philadelphia: Elsevier Saunders; 2012.
2. Pibarot P, Dumesnil JG. Prosthesis-patient mismatch: definition, clinical impact, and prevention. Heart. 2006;92:1022-1029. doi: 10.1136/hrt.2005.067363.
3. Tam DY, Dharma C, Rocha RV, Ouzounian M, Wijeysundera HC, Austin PC, et al. Early outcomes following aortic root enlargement: a multicenter propensity score-matched cohort analysis. J Thorac Cardiovasc Surg. 2020;160(4):908-919. doi: 10.1016/j.jtcvs.2019.09.062.
4. Rocha RV, Manlhiot C, Feindel CM, Yau TM, Mueller B, David TE, et al. Surgical enlargement of the aortic root does not increase the operative risk of aortic valve replacement. Circulation. 2018;137:1585-1594. doi: 10.1161/CIRCULATIONAHA.117.030525.
5. Globo Repórter. Pesquisa e ciência estimulam a criatividade dos gênios. Disponível em: http://g1.globo.com/globo-reporter/noticia/2012/05/pesquisa-e-ciencia-estimulam-criatividade-dos-genios.html
6. Doty D, Doty J. Cardiac surgery operative technique. 2nd ed. Philadelphia: Elsevier Saunders; 2012.
7. Nicks R, Cartmill T, Bernstein L. Hypoplasia of the aortic root. The problem of aortic valve replacement. Thorax. 1970;25:339-346.
8. Roeser ME. The Konno-Rastan procedure for anterior aortic annular enlargement. Oper Tech Thorac Cardiovasc Surg. 2016;20(3):219-233. doi: 10.1053/j.optechstcvs.2016.02.005.