Os primórdios do coração humano
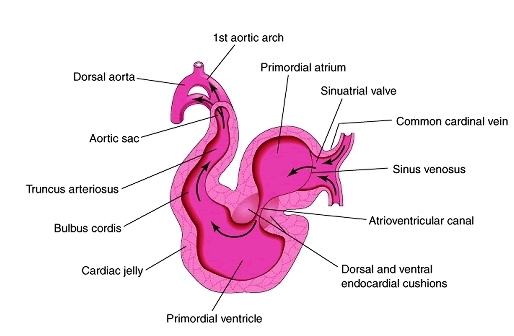
O coração humano surge primordialmente ao 18º dia de desenvolvimento do embrião. Células mesenquimais formam cordões angioblásticos, que se canalizam em tubos endocárdicos e se fundem para formar um único tubo cardíaco. Essa fusão ocorre de forma crânio-caudal, entre o 22º e 28º dia. Assim, o tubo endotelial torna-se o endocárdio, o miocárdio primitivo torna-se a parede muscular do coração e o epicárdio deriva de células mesoteliais que se originam da superfície externa do seio venoso. Com o dobramento cefálico, o coração tubular se alonga e desenvolve dilatações e constrições alternadas, que formarão tronco arterial, bulbo cardíaco, ventrículo primitivo, átrio primitivo e seio venoso. Em seguida, ocorre o dobramento cardíaco, no qual as estruturas do coração que antes encontravam-se em série, ou seja, conectadas desde a extremidade venosa até a extremidade arterial por um tubo reto, tornam-se agora paralelas, formando as quatro futuras câmaras do coração, já em suas posições exatas.¹
Distribuição e débito cardíaco
Em torno do 22° dia de gestação, o coração fetal ensaia as suas primeiras batidas, que permanecerão constantes até o fim daquela vida. Isso indica o início da circulação fetal. Os detalhes estruturais do coração são organizados durante o período embrionário, mas dependem também do ambiente físico, incluindo o fluxo sanguíneo, para se desenvolver normalmente. O coração fetal tem capacidade limitada, pois os ventrículos já estão operando com o máximo de seus potenciais. Além disso, o mecanismo de Frank-Starling opera no órgão em desenvolvimento, e o impulso adrenérgico também altera a curva de função para aumentar o volume sistólico. No entanto, o aumento da frequência cardíaca parece ser o meio mais importante de aumentar o débito cardíaco fetal, essencial, portanto, para o seu desenvolvimento adequado.²
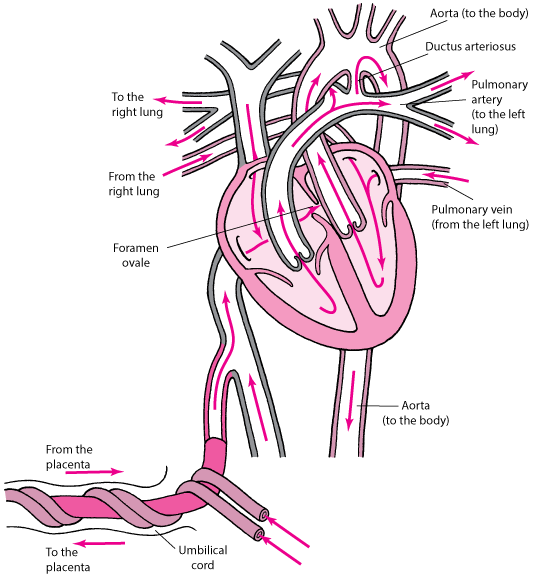
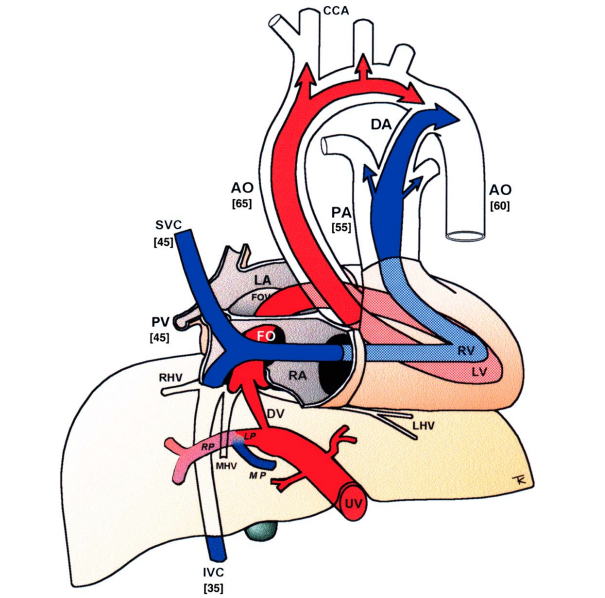
Ademais, a circulação sistêmica fetal é alimentada pelos ventrículos esquerdo e direito em paralelo. Os três shunts (ducto venenoso, ducto arterioso e forame oval) são arranjos distribucionais essenciais que tornam a circulação fetal um sistema flexível e adaptado para a vida intrauterina. A via do sangue oxigenado, também chamada de via sinistra, sai da veia umbilical, atravessa o ducto venoso e alcança o forame oval, ventrículo esquerdo e aorta, alimentando assim os circuitos coronário e cerebral. Por outro lado, uma via dextra é responsável por direcionar o sangue desoxigenado das veias cava, uma vez que atravessa a válvula tricúspide, tronco pulmonar e canal arterial, até alcançar a aorta descendente, ignorando o circuito pulmonar. Logo, a menor saturação de oxigênio é encontrada na veia cava inferior (VCI) abdominal, e a maior na veia umbilical (VU). Curiosamente, a diferença de saturação entre os ventrículos esquerdo e direito é de apenas 10% na vida intrauterina, o que se deve ao abundante volume de sangue oxigenado presente no forame oval.²
Ducto venoso e circulação hepática
No feto humano, o ducto venoso é uma derivação delgada, semelhante a uma trombeta, que conecta a VU intra-abdominal à VCI, em sua entrada para o coração. A entrada do ducto venoso, o istmo, tem um diâmetro médio de 0,5 mm no meio da gestação e dificilmente ultrapassa 2 mm em uma gravidez normal. Além disso, a pressão venosa umbilical varia de 2 a 9 mmHg (que é o gradiente de pressão portocaval) e faz com que o sangue acelere de 10-22 cm/s na VU para 60-85 cm/s conforme entra no ducto venoso e flui em direção à VCI e ao forame oval.²
Forame oval
O forame oval pode ser caracterizado como uma abertura na porção baixa do septo interatrial do coração, que enche as duas câmaras como uma coluna de sangue a partir de baixo. Essa coluna se divide em um braço esquerdo, entre a válvula do forame oval e o septo atrial para entrar no átrio esquerdo, e um direito, que se junta ao fluxo da veia cava superior e seio coronário para formar a via dextra. O forame gera um equilíbrio facilmente influenciado por mudanças de pressão, em ambos os lados. O ventrículo em desenvolvimento responde às demandas da pós-carga e é estimulado pelo volume de sangue da pré-carga. No entanto, para o lado esquerdo do coração, o forame oval é um fator limitante para o seu crescimento, particularmente em casos de forame mal desenvolvido ou fechamento prematuro.²
Ducto arterioso e circulação pulmonar
O canal arterial/ducto arterioso constitui um amplo vaso muscular que conecta o tronco arterial pulmonar à aorta descendente. Durante o segundo trimestre, a velocidade no canal arterial aumenta mais do que no tronco pulmonar e, normalmente, o shunt fecha 2 dias após o nascimento, apesar de um ducto patente ser um problema clínico comum. Um aumento na tensão de oxigênio é considerado o principal gatilho para o seu fechamento. Ademais, o vaso está sob a influência geral de substâncias, particularmente a prostaglandina E2, que é crucial para manter sua patência. A sensibilidade aos antagonistas dessa substância atinge seu pico no terceiro trimestre e é aumentada pelos glicocorticóides e por estresse fetal.²
Circulação fetoplacentária
Estudos Doppler de gestações de baixo risco descobriram que um terço do débito cardíaco fetal é direcionado para a placenta entre a 20° e 32° semanas de gestação, mas isso diminui para aproximadamente um quinto além dessa faixa de tempo. A resistência ao fluxo é determinada principalmente pelo leito vascular periférico da placenta, o qual não apresenta regulação neural e sofre pouca influência das catecolaminas. Dessa forma, é sabido que o aumento substancial na seção transversal vascular durante o final da gestação é responsável por uma redução na impedância e a queda correspondente na pulsatilidade da artéria umbilical.²
Anomalias no desenvolvimento cardíaco
Na circulação fetal, o lado direito do coração tem pressões mais altas do que o lado esquerdo. Esta diferença permite que os shunts permaneçam abertos. Na circulação pós-natal, quando o bebê respira pela primeira vez, a resistência pulmonar diminui e o fluxo sanguíneo pela placenta cessa. O sangue começa a fluir pelos pulmões e a pressão no lado esquerdo fica mais alta do que no direito. Como resultado, é esperado o fechamento dos shunts.⁴
Os defeitos cardíacos congênitos surgem principalmente quando os shunts não se fecham após o nascimento. Esses defeitos podem ser cianóticos ou acianóticos. Os primeiros são tipicamente causados por shunts da direita para a esquerda após o nascimento, no qual o sangue desoxigenado contorna os pulmões e entra na circulação sistêmica, e o bebê pode parecer azul ao nascer. Exemplos incluem a tetralogia de Fallot, transposição das grandes artérias, tronco arterioso persistente, atresia tricúspide e retorno venoso pulmonar anômalo total. Por outro lado, os defeitos cardíacos acianóticos são tipicamente shunts da esquerda para a direita, sem sangue desoxigenado entrando na circulação sistêmica, mas com parte do sangue oxigenado indo para o lado direito do coração e viajando novamente pelos pulmões. Isso ocorre, por exemplo, em defeitos do septo atrial, do septo ventricular, persistência do canal arterial e forame oval patente. Assim, inicialmente o bebê não parece azul ao nascer, contudo, o shunt pode evoluir para uma sobrecarga grave do coração direito devido ao aumento do fluxo sanguíneo, o que aumenta a resistência vascular pulmonar. Eventualmente, o ventrículo direito hipertrofia e a pressão no lado direito do coração torna-se mais significativa do que no lado esquerdo. Como resultado, o shunt reverte e torna-se da direita para a esquerda (síndrome de Eisenmenger).⁴
Por último, as malformações vasculares também podem resultar em defeitos congênitos. A coarctação da aorta, por exemplo, desenvolve-se quando há constrição do arco aórtico distal ao local onde a artéria subclávia se ramifica. Pré-ductal indica que a constrição é anterior ao canal arterial e pós-ductal indica que é após. Na primeira, o sangue desoxigenado viaja do átrio para o ventrículo direitos e, em seguida, atravessa a artéria pulmonar. Como uma persistência do canal arterial está presente a jusante, esse sangue desoxigenado passa para a aorta após o ponto de constrição. O contrário ocorre na coarctação pós-ductal, ou seja, o sangue desoxigenado não passa para o lado esquerdo.⁴
Origem genética dos defeitos cardíacos
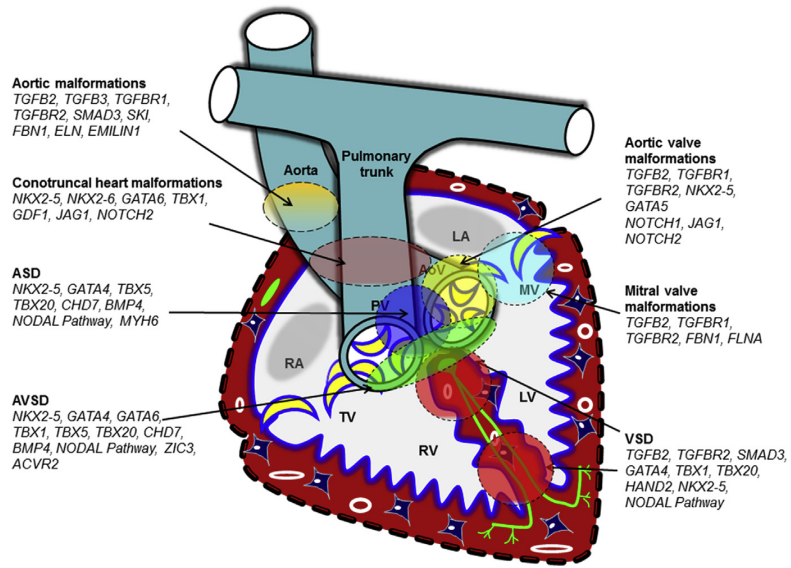
Estudos em modelos animais indicam que a perda de um único gene pode resultar em um espectro de malformações cardiovasculares. Por exemplo, as malformações de via de saída dos fetos com deficiência de TGFb2 (fator de crescimento beta2) incluem: dupla via de saída do ventrículo direito ou esquerdo, tronco arterioso persistente, morfologia anormal e espessamento das válvulas cardíacas, além de malformações do arco aórtico. Diferentes fenótipos de malformações cardiovasculares são observados em pacientes com mutações idênticas, mesmo entre membros da mesma família. Outros exemplos incluem mutações nulas, que podem causar defeito do septo atrioventricular, em genes como Nkx2-5, Gata4 e Tbx1. Os mecanismos de desenvolvimento que causam diferentes malformações cardiovasculares em resposta a uma mutação em um único gene permanecem apenas parcialmente compreendidos.⁵
A influência da epigenética
Além disso, há um crescente reconhecimento dos fatores epigenéticos como subjacentes às malformações cardiovasculares. Epigenética se refere a mudanças funcionalmente relevantes no genoma que não envolvem uma mudança na sequência do DNA. A metilação do DNA e a modificação das histonas são os principais mecanismos epigenéticos que alteram a remodelação da cromatina e a expressão gênica sem alterar a informação genética subjacente. Um estudo do Pediatric Cardiac Genomics Consortium do National Heart, Lung and Blood Institute identificou mutações pontuais de novo em várias histonas, que contribuem coletivamente para aproximadamente 10% das malformações congênitas graves. Refinamentos em tecnologias como ChIP-seq (sequenciamento de imunoprecipitação da cromatina) e abordagens de biologia de sistemas auxiliam na compreensão da regulação global e redundâncias funcionais em fatores de transcrição cardíaca, nessas anomalias. Ademais, sabe-se também que microRNAs, uma classe de pequenos RNAs não codificantes, regulam negativamente a expressão de seus genes-alvo por meio de processos pós-transcricionais, interagindo também com a maquinaria epigenética.⁵
Rastreio de cardiopatias congênitas
O diagnóstico pré-natal das cardiopatias congênitas requer uma abordagem multidisciplinar, que contemple pré-natais eficazes, triagem adequada por ultrassonografistas treinados, interpretação confiável e a capacidade de encaminhar a um cardiologista pediátrico. Apesar de existir triagem obstétrica universal, as taxas de diagnóstico pré-natal de cardiopatia congênita variam muito e permanecem baixas em certas áreas. As diretrizes atuais do Instituto Americano de Ultrassom em Medicina, do Colégio Americano de Radiologia e do Colégio Americano de Ginecologia e Obstetrícia, recomendam que as mulheres façam um exame de ultrassom morfológico entre 18 e 20 semanas de idade gestacional. O exame cardíaco, nesse âmbito, foi inicialmente limitado a uma visão das quatro câmaras do coração, que corresponde a uma detecção de 50% das malformações graves. Mais recentemente, contudo, também foi incluída a avaliação dos folhetos de saída, o que aumentou as taxas de detecção para 90%.⁶
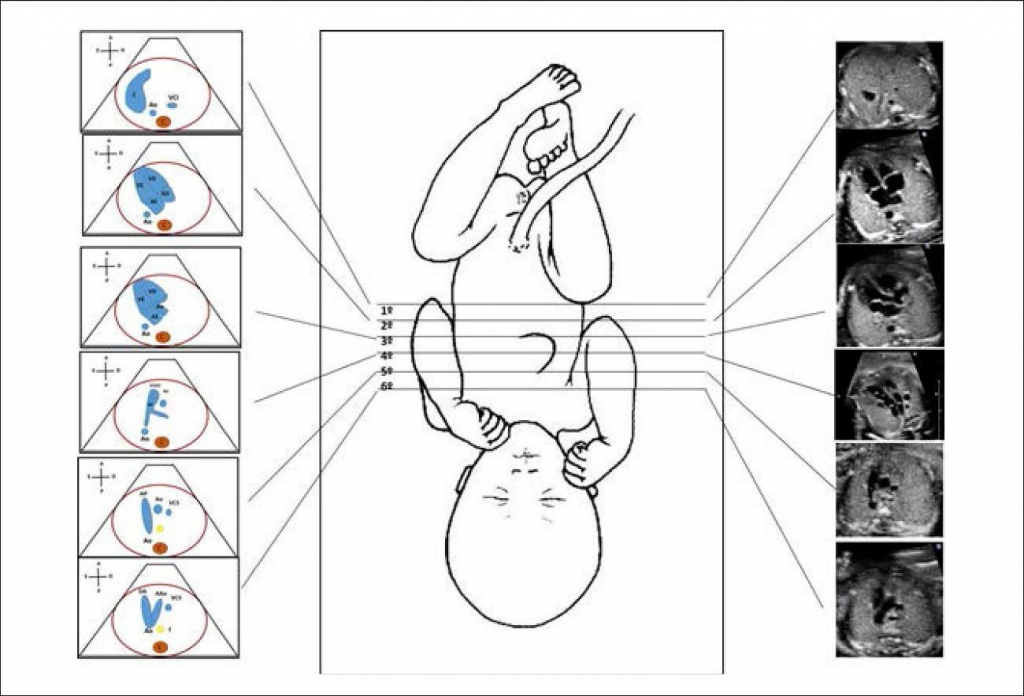
Ecocardiograma fetal
A ecocardiografia fornece uma avaliação detalhada da estrutura e função do sistema cardiovascular fetal para garantir um diagnóstico preciso e orientar aconselhamento e manejo perinatais. As indicações para tal exame são divididas em fatores maternos e fetais, publicadas pela American Heart Association, em 2014.⁸ A principal delas é um ultrassom de rastreamento obstétrico anormal. O momento do ecocardiograma deve ser determinado pelo motivo do encaminhamento. Embora a ecocardiografia fetal possa ser realizada no primeiro trimestre, o momento ideal para visualizar a anatomia fetal por uma abordagem transabdominal é entre 18 e 22 semanas de gestação, uma vez que um ecocardiograma antes desse período de tempo pode levar a uma avaliação incompleta e, após a 30° semana de gestação, culmina em uma visualização prejudicada por conta da sombra óssea e aumento da massa fetal em comparação com o volume de líquido amniótico.⁶
Portanto, apesar do aumento da triagem e das taxas de detecção melhoradas, a maioria dos defeitos cardíacos permanece sem diagnóstico pré-natal. Se houver suspeita, a mãe deve ser encaminhada a um cardiologista pediátrico o mais rápido possível, a fim de realizar a confirmação do diagnóstico, aconselhamento apropriado e encaminhamento a um centro capaz de tratar defeitos cardíacos congênitos complexos. O diagnóstico pré-natal precoce também permite a opção de intervenções paliativas ou terapêuticas ainda intra útero, o que permite que mais pacientes se beneficiem potencialmente dessas medidas de rastreio.
Conclusão
O cuidado cardiovascular perinatal evoluiu consideravelmente desde seu início, há mais de quatro décadas, para se tornar seu próprio campo de atenção multidisciplinar. Apesar dos avanços, ainda existem lacunas significativas na prestação de cuidados ideais para feto, criança, mãe e família. O avanço contínuo na detecção e diagnóstico, cuidado perinatal e planejamento do parto, além da previsão e melhoria da morbimortalidade para fetos com condições cardíacas, como defeitos anatômicos ou distúrbios funcionais e de ritmo, requer colaboração entre os vários tipos de especialistas e provedores.⁹
REFERÊNCIAS
¹ Faculdade de Medicina de Marília. Desenvolvimento do Coração: disciplina de embriologia humana. Disponível em: https://www.famema.br/ensino/embriologia/sistemacardiovascularcoracao.php. Acesso em: 27 ago. 2021.
² Kiserud, T. Physiology of the fetal circulation. Seminars In Fetal And Neonatal Medicine, [S.L.], v. 10, n. 6, p. 493-503, dez. 2005. Elsevier BV. http://dx.doi.org/10.1016/j.siny.2005.08.007.
³ Manual MSD. A circulação normal em um feto. Disponível em: https://www.msdmanuals.com/pt-pt/casa/multimedia/figure/ped_normal_circulation_fetus-cv_pt. Acesso em: 27 ago. 2021.
⁴ Remien, K; Majmundar, S. Physiology, Fetal Circulation. 2021. Disponível em: https://www.ncbi.nlm.nih.gov/books/NBK539710/. Acesso em: 27 ago. 2021.
⁵ Azhar, M; Ware, S. Genetic and Developmental Basis of Cardiovascular Malformations. Clinics In Perinatology, [S.L.], v. 43, n. 1, p. 39-53, mar. 2016. Elsevier BV. http://dx.doi.org/10.1016/j.clp.2015.11.002.
⁶ McLaughlin, E; Schlosser, B; Border, W. Fetal Diagnostics and Fetal Intervention. Clinics In Perinatology, [S.L.], v. 43, n. 1, p. 23-38, mar. 2016. Elsevier BV. http://dx.doi.org/10.1016/j.clp.2015.11.003.
⁷ Pedra, S; Zielinsky, P; Binotto, C; et al. Brazilian Fetal Cardiology Guidelines – 2019. Arquivos Brasileiros de Cardiologia, [S.L.], v. 5, n. 112, p. 600-648, maio 2019. Sociedade Brasileira de Cardiologia. http://dx.doi.org/10.5935/abc.20190075.
⁸ Donofrio, M; Moon-Grady, A; Hornberger, L; et al. Diagnosis and Treatment of Fetal Cardiac Disease. Circulation, [S.L.], v. 129, n. 21, p. 2183-2242, 27 maio 2014. Ovid Technologies (Wolters Kluwer Health). http://dx.doi.org/10.1161/01.cir.0000437597.44550.5d.
⁹ Pinto, N; Morris, S; Moon-Grady, A; Donofrio, M. Prenatal cardiac care: goals, priorities & gaps in knowledge in fetal cardiovascular disease. Progress In Pediatric Cardiology, [S.L.], v. 59, p. 101312, dez. 2020. Elsevier BV. http://dx.doi.org/10.1016/j.ppedcard.2020.101312.
17