O transplante de coração aumentou a sobrevida de milhares de crianças com insuficiência cardíaca em estágio terminal, em muitos países. Apesar das conquistas, uma em cada cinco crianças morrerá enquanto estiver em listas de espera devido à indisponibilidade de um doador adequado. Para crianças menores de 5 anos, a disponibilidade de doadores é ainda mais reduzida e a mortalidade na lista de espera aumenta. Portanto, esforços têm sido feitos a fim de expandir o pool de doadores nessa população.¹
Contudo, isso não é fácil. Ainda não se conseguiu vencer o cronômetro de um órgão, o seu caminhar natural para a deterioração pós morte do doador. Além disso, sabe-se que o transplante é uma das poucas áreas da medicina em que o padrão de atendimento, pelo menos para o órgão, permanece praticamente o mesmo que era há mais de cinco décadas. Desde que Joseph Murray transplantou com sucesso o primeiro rim em 1954, os órgãos foram armazenados e transportados em uma caixa de gelo. Hoje, o armazenamento refrigerado estático, como é conhecido o método da caixa de gelo, continua sendo o padrão ouro para a maioria dos 130.000 transplantes de órgãos realizados anualmente em todo o mundo.²
O método da caixa de gelo
A simplicidade da técnica de armazenamento refrigerado estático foi a chave para seu sucesso, mas impõe limites rígidos sobre o tempo no qual os órgãos podem ser armazenados, antes que os danos os tornem impróprios para uso. Ela é efetivamente um exercício de limitação de danos, uma vez que se propõe a desligar o metabolismo e, com ele, os processos prejudiciais como inflamação. Contudo, a lesão isquêmica, ou seja, a morte do tecido devido à falta de oxigênio, torna o coração inutilizável após 4-6 h e, mesmo se usado dentro dessas janelas apertadas de tempo, o órgão não pode ser avaliado de forma significativa, nem idealmente combinado com seu destinatário. Essas restrições, juntamente com uma contínua escassez de doadores, ajudam a explicar algumas estatísticas preocupantes: há mais de 100.000 pacientes em listas de espera de órgãos nos Estados Unidos e, em 2017, menos de um terço deles recebeu um órgão. Além disso, menos de 2% das mortes levam à doação de órgãos elegível. E, por fim, 40% dos receptores de coração sofrem rejeições agudas, em um ano.²

Tecnologia de perfusão ex vivo
A maioria dos órgãos são recrutados dos chamados doadores com “morte cerebral”. Os cérebros desses pacientes perderam irreversivelmente todas as funções, mas seus corações são mantidos em funcionamento por máquinas, que mantêm seus órgãos viáveis por um tempo. A tecnologia de perfusão ex vivo está ajudando a expandir esse pool para incluir órgãos de um grupo muito maior: pacientes cujos corações pararam e aqueles com condições que normalmente impediriam o transplante.²
Os avanços na tecnologia de perfusão ex vivo tem como vantagens ganhar tempo para transportar órgãos por distâncias maiores, proporcionar o monitoramento e a avaliação de órgãos e uma melhor correspondência de receptores. Além disso, ao permitir que órgãos subótimos ou doentes sejam reparados, aumenta-se a utilidade das coortes de doadores atuais, reduzindo o desperdício e aumentando as chances de aqueles em lista de espera receberem o tão sonhado coração.²
Mas, afinal, o que é doação após morte circulatória (DPM)?
DPM refere-se à recuperação de órgãos para transplante de um paciente cuja morte é diagnosticada e confirmada por meio de critérios cardiorrespiratórios. Isso significa que o processo de doação para transplante pode começar após o coração parar de bater, caso a morte seja confirmada e a doação consentida pela família do paciente. Usando tecnologias de perfusão ex vivo, os médicos são capazes de reanimar o coração, medicá-lo e mantê-lo batendo fora do corpo humano, tornando-o viável enquanto é transportado para o paciente receptor.⁴
Como funciona?
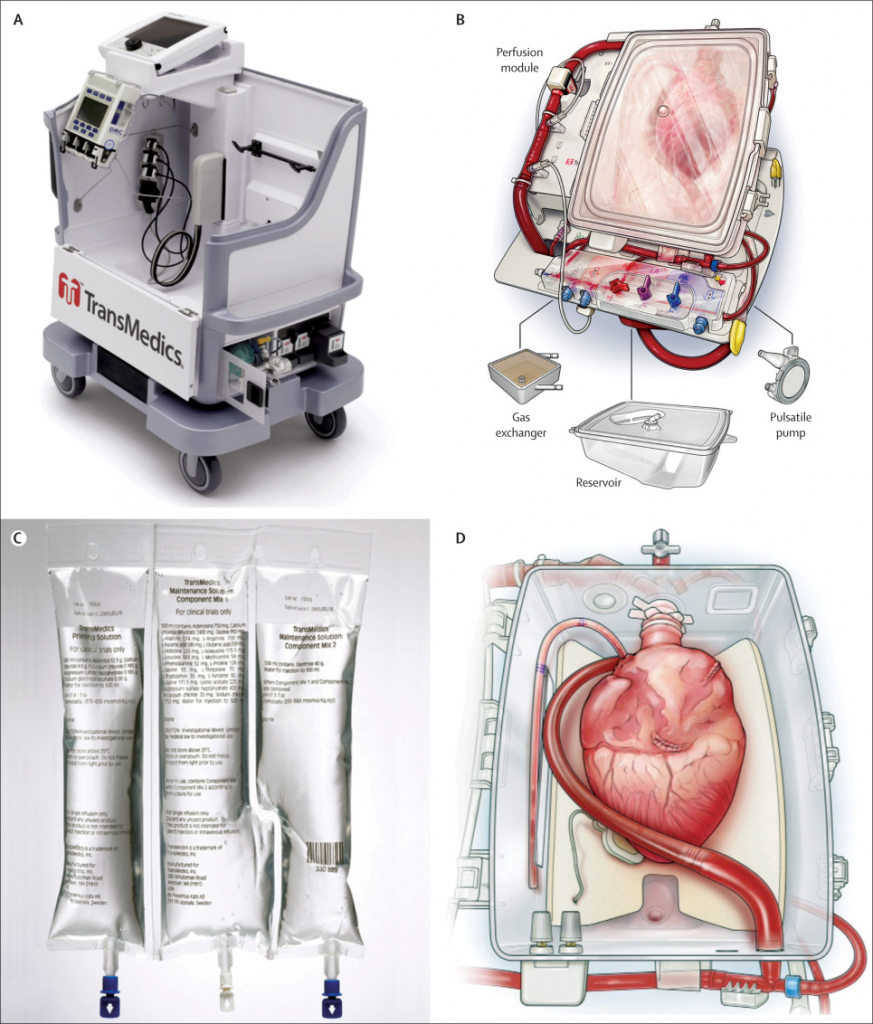
Várias empresas desenvolveram sistemas de perfusão ex vivo com o objetivo de atenuar a lesão isquêmica durante a preservação de órgãos. Um dos exemplos mais estudados e testados clinicamente para transplante cardíaco foi o TransMedics ™ Organ Care System (OCS). Este dispositivo portátil é preparado com sangue do doador heparinizado, misturado com uma solução de perfusão patenteada.⁵ Duas infusões são aplicadas no reservatório de sangue para permitir a preservação da função cardíaca: uma contendo predominantemente adenosina em uma solução de manutenção e a outra adrenalina. A solução contendo adenosina é usada como vasodilatador coronário e a solução de adrenalina como vasoconstritor e cronotrópico. Uma vez no dispositivo, o coração é mantido em um modo não funcional, mas metabolicamente ativo, no qual ele é drenado via sistema de drenagem intracardíaco de volta ao reservatório. O coração vai bater na plataforma, embora não sob carga. O sistema monitora parâmetros, incluindo pressão aórtica e fluxo coronário, com infusões e fluxos de bomba ajustados para manter esses parâmetros dentro de uma faixa recomendada. Gasometria arterial e venosa são obtidas em intervalos regulares, com foco no lactato. Um lactato abaixo de 5mmol/L é considerado favorável para o transplante.⁶ Os eletrodos de estimulação epicárdica permitem que o coração seja estimulado e os eletrodos de desfibrilação são incorporados ao sistema, caso seja necessário. Esse dispositivo permitiu alcançar uma perfusão clínica bem-sucedida por períodos prolongados de tempo.⁵
Doação pós morte circulatória para crianças
Nesse sentido, o ano de 2020, apesar de ser narrado em meio a uma catastrófica pandemia que movimentou recursos hospitalares e humanos, conseguiu alcançar um recorde mundial em termos de transplantes cardíacos pediátricos. Isso aconteceu no Reino Unido e foi possível a partir de uma parceria entre o Great Ormond Street Hospital (GOSH) e o Royal Papworth Hospital (RPH), que colaboraram para introduzir uma técnica mundial de transplante cardíaco pediátrico que busca expandir o pool de doadores e aumentar o número de transplantes para crianças elegíveis no Reino Unido em 50%.⁴
O programa de transplante DPM estava anteriormente disponível apenas para adultos. Pela primeira vez, usando o sistema portátil OCS, a técnica foi disponibilizada para crianças, abrindo caminho para seis transplantes de coração no ano de 2020.⁸ Levando em conta que a preservação dos corações entre a coleta de um doador e a implantação em um receptor é uma limitação ao transplante e que, atualmente, os corações são mantidos temporariamente em armazenamento frio, o que leva a lesões isquêmicas e de reperfusão dependentes do tempo, essa técnica mostra-se como uma possível solução eficaz para perfusão cardíaca ex vivo na população infanto-juvenil.⁹
A máquina OCS é atualmente o único dispositivo médico capaz de tornar o transplante cardíaco com DPM uma realidade clínica. Embora esta tecnologia limite a doação para doadores que pesem pelo menos 50 kg, as equipes da RPH e GOSH estão trabalhando juntas para desenvolver uma nova máquina que permitirá a doação de bebês menores, abrindo um novo horizonte de perspectivas para o transplante em bebês e crianças pequenas, que possuem doadores mais escassos.⁴ O GOSH tem atualmente 24 crianças à espera de um transplante cardíaco e, entre 2014 e 2019, o tempo médio de espera foi de 282 dias. Apesar da pandemia da COVID-19, o serviço de transplante de coração e pulmão continuou funcionando. No ano passado, a equipe clínica realizou um recorde de 24 transplantes de coração no hospital, impulsionados pelos seis corações em DPM ao público pediátrico.⁴
Uma porta que é aberta com o armazenamento quente: a terapia gênica
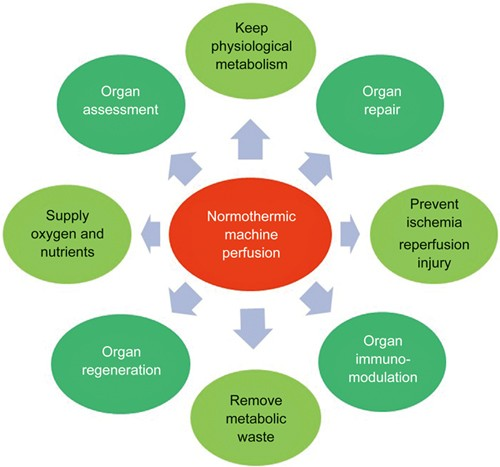
Embora o objetivo principal do armazenamento normotérmico de um órgão seja reduzir a lesão de isquemia-reperfusão, melhorar a segurança e estender o tempo da fase de preservação, ele também isola o enxerto cardíaco metabolicamente ativo, permitindo uma potencial modificação biológica. Logo, em relação à possível terapia gênica, este tipo de armazenamento permite a infusão intracoronária de altas concentrações de vetores virais com recirculação contínua e em condições metabolicamente favoráveis.⁵
Uma abordagem de terapia genética bem-sucedida com base em vetores virais requer três elementos: veículo de entrega (uma cápsula), um alvo terapêutico (um transgene) e um método físico de entrega no tecido de interesse (injeção direcionada, administração intravenosa, dentre outros). A prova do benefício da terapia gênica no contexto do transplante cardíaco para melhorar as respostas deletérias ao enxerto, no receptor, foi demonstrada em modelos de transplante cardíaco em roedores usando armazenamento estático a frio ou métodos de perfusão de Langendorff. Das duas abordagens de perfusão, é improvável que o armazenamento de órgãos padrão de cuidado (armazenamento estático a frio) facilite a tradução da terapia gênica para transplante, uma vez que muitos aspectos do processo de transdução do vetor viral, como entrada do receptor, captação, tráfego através da célula, importação nuclear e desmontagem eficiente são dependentes da temperatura e do metabolismo. Sistemas de perfusão isolados, como o Langendorff, têm sido utilizados experimentalmente por mais de 90 anos em pesquisas fisiológicas e farmacológicas para avaliar a função cardíaca ex vivo. Essas estratégias de perfusão mantêm o metabolismo normotérmico e aeróbio, facilitando as etapas bioquímicas e moleculares necessárias para a captação viral no coração.⁵
Portanto, essa tecnologia genética, aliada a técnica de armazenamento normotérmico, introduz a oportunidade para modificação biológica do aloenxerto antes da implantação, o que pode melhorar os resultados pós-transplante. Nesse sentido, o desenvolvimento de abordagens clínicas específicas para DPM é fundamental, porque as práticas atuais para obtenção, avaliação e armazenamento de coração de doadores foram otimizadas para a doação convencional após morte encefálica, sem considerar a isquemia quente.¹⁰
Comparando: armazenamento normo ou hipotérmico?
Um aspecto um tanto controverso da perfusão ex vivo é a seleção da temperatura ideal para perfusão. A perfusão hipotérmica a cerca de 4°C mostrou benefícios em relação ao armazenamento estático, mas pesquisas mais recentes sugerem que a perfusão quente, em temperaturas fisiológicas, pode trazer benefícios ainda maiores para alguns órgãos. O debate sobre a temperatura está emaranhado com a questão de se as máquinas precisam ser portáteis, ou seja, não apenas disponíveis no hospital do doador, mas também transportáveis para o receptor, mantendo o órgão em uma temperatura fisiológica constante.²
O crescente interesse comercial em toda a área significa que os vários estudos em andamento estão sendo feitos com diferentes protocolos e máquinas, normalmente comparando uma combinação proprietária com o armazenamento refrigerado estático, em vez de um com o outro. Dispositivos que oferecem preservação de máquina em baixa temperatura – um passo além da caixa de gelo – ganharam a tração mais comercial. É nada mais que uma abordagem pragmática: organizações de aquisição de órgãos e cirurgiões de transplante já estão engajados em trabalhos de alto risco que salvam vidas. A comunidade de transplantes tem quase 50 anos de experiência no uso da preservação a frio como um padrão seguro e eficaz de tratamento e tem medo de abraçar riscos clínicos adicionais. Se a máquina fria quebrar, o órgão reverte para armazenamento refrigerado estático. Se uma máquina normotérmica falhar, o órgão provavelmente será perdido ou comprometido.²
A experiência e as evidências estão se acumulando para sugerir que a perfusão normotérmica oferece chances de um transplante onde não existia antes, e com maior potencial para melhorar a qualidade do órgão antes do procedimento. A perfusão quente certamente permite uma avaliação mais precisa, porque o órgão está funcionando em sua taxa metabólica normal. Com a DPM, os corações a serem transplantados passam por um período de isquemia quente antes da obtenção, o que é particularmente preocupante porque o dano ao tecido ocorre rapidamente e pode ser suficiente para impedir o transplante. No entanto, o coração é capaz de resistir a períodos limitados de isquemia quente, e isso pode fornecer uma janela de oportunidade para o transplante.¹⁰ Logo, é razoável supor que um órgão mantido em sua temperatura fisiológica normal, fornecido com tudo ou a maior parte do que normalmente recebe, terá um desempenho melhor do que aquele bombeado a frio (embora todos os órgãos, após a extração, sejam lavados com solução fria para limpar o sangue, células danificadas e substâncias inflamatórias).¹¹
No entanto, temperaturas mais baixas podem ajudar a proteger as células contra lesões de reperfusão, os danos incorridos quando células com falta de oxigênio são reabastecidas com sangue quente. Estudos recentes sugerem que o frio pode ajudar a recondicionar e reabastecer as mitocôndrias, reduzindo assim os níveis de espécies reativas de oxigênio, que desencadeiam cascatas inflamatórias. Cada redução de 10 graus reduz pela metade a velocidade das reações químicas, estendendo a preservação.¹²
Também se investiga a preservação térmica em temperatura ambiente (abaixo do normal) em cerca de 21 °C. Isso sujeita as células a um salto menos extremo na temperatura do armazenamento refrigerado. Poderia, portanto, ser um ponto ideal onde os mecanismos de reparo estão ativos, mas as taxas de danos são reduzidas.²
Por fim, a solução ideal pode estar em capturar as vantagens da perfusão quente e fria. Ao extrair um órgão, o frio dá essa proteção, assim como quando se coloca de volta. Um meio termo é lembrar que existe uma temperatura certa para a hora certa. Logo, pensa-se em variáveis que podem ser combinadas, alternando-se entre a normotermia, durante a qual é possível avaliar, tratar e acelerar a recuperação, e a hipotermia, onde o órgão pode descansar e alguns processos negativos podem ser desligados. Um protocolo combinado frio-quente eliminaria a necessidade de todos os locais doadores terem uma máquina de perfusão ex vivo quente à mão. E, ao expandir o tempo de armazenamento de horas para potencialmente um dia ou mais, sustenta-se uma visão de hospitais capazes de recondicionarem o coração, enviá-lo resfriado para outra localidade, na qual será realizada uma avaliação e reparação por equipes de especialistas mediante um segundo aquecimento, até o órgão finalmente ser despachado para destinatários correspondentes.¹²
E nas crianças?
Particularmente abordando o dispositivo OCS, no qual se busca uma promessa de expansão do pool de doadores pediátricos, deve-se também refletir qual a melhor opção para armazenamento do coração. Estudos comparativos evidenciam que o tempo total durante o qual um coração esteve fora do corpo foi, em média, mais longo com o OCS do que com armazenamento refrigerado (324 min versus 195 min). Acredita-se que, além de reduzir o tempo de isquemia fria, a tecnologia do OCS pode permitir um tempo de preservação mais longo, o que poderia melhorar o compartilhamento e a correspondência de órgãos.⁹ No entanto, em um artigo publicado no The Lancet, debateu-se que a redução no tempo de isquemia fria não foi associada a nenhum benefício clínico e, portanto, que a preservação ideal do coração do doador pode ser mais complicada do que simplesmente evita-la.⁷ Em um segundo artigo, constatou-se função cardíaca normal em 1 semana após transplante de três pacientes, apesar da necessidade de suporte mecânico temporário em alguns casos. Com base na metodologia utilizada, sugere-se que o aumento da resiliência ao inevitável período de isquemia quente pode ser alcançado por meio da adição de agentes pós-condicionamento à cardioplegia usada para proteção miocárdica. Dessa maneira, o OCS pode funcionar como uma plataforma para instrumentar o coração do doador e reanimá-lo na máquina, com posterior suporte, recondicionamento e avaliação funcional.¹³
Logo, resta um dilema entre equilibrar a proteção e a sensibilidade aos doadores com a necessidade de aumentar a disponibilidade de corações viáveis para transplante. Revisitar uma posição consensual sobre a definição da própria morte pode ser uma necessidade para endossar o verdadeiro valor do sistema ex vivo em corações coletados após a declaração de óbito circulatório.⁹
REFERÊNCIAS
¹ Fenton M. Blood group-incompatible heart transplantation in children-an idea worth spreading. Lancet Child Adolesc Health. 2021;5(5):313-314. doi:10.1016/S2352-4642(21)00067-5
² Senior, M. Beating the organ clock. Nat Biotechnol 36, 488–492 (2018). https://doi.org/10.1038/nbt.4157
³ DAIC. SherpaPak Cardiac Transport System Cleared for Pediatric and Small Donor Hearts. Disponível em: https://www.dicardiology.com/product/sherpapak-cardiac-transport-system-cleared-pediatric-and-small-donor-hearts. Acesso em: 8 jun. 2021
⁴ NHS. World-first paediatric heart transplant technique boosts number of life-saving operations for children in the UK. 2021. Disponível em: https://www.organdonation.nhs.uk/get-involved/news/world-first-paediatric-heart-transplant-technique-boosts-number-of-life-saving-operations-for-children-in-the-uk/. Acesso em: 8 jun. 2021.
⁵ Bishawi, M., Roan, JN., Milano, C.A. et al. A normothermic ex vivo organ perfusion delivery method for cardiac transplantation gene therapy. Sci Rep 9, 8029 (2019). https://doi.org/10.1038/s41598-019-43737-y
⁶ STAMP, N. L. et al. Successful Heart Transplant after Ten Hours Out-of-body Time using the TransMedics Organ Care System. Heart, Lung And Circulation, [S.L.], v. 24, n. 6, p. 611-613, jun. 2015. Elsevier BV. http://dx.doi.org/10.1016/j.hlc.2015.01.005
⁷ Ardehali, A. et al. (2015). Ex-vivo perfusion of donor hearts for human heart transplantation (PROCEED II): a prospective, open-label, multicentre, randomised non-inferiority trial. The Lancet, 385(9987), 2577–2584. doi:10.1016/s0140-6736(15)60261-6
⁸ Collinson, A; Buchanan, R. Child heart transplants: Record year for new-style operations. 2021. Disponível em: https://www.bbc.com/news/health-56127933. Acesso em: 8 jun. 2021
⁹ Lim, G. Ex vivo perfusion of human hearts—implications for donor organ availability. Nat Rev Cardiol 12, 317 (2015). https://doi.org/10.1038/nrcardio.2015.69
¹⁰ Longnus, S., Mathys, V., Dornbierer, M. et al. Heart transplantation with donation after circulatory determination of death. Nat Rev Cardiol 11, 354–363 (2014). https://doi.org/10.1038/nrcardio.2014.45
¹¹ Jing, L., Yao, L., Zhao, M. et al. Organ preservation: from the past to the future. Acta Pharmacol Sin 39, 845–857 (2018). https://doi.org/10.1038/aps. 2017.182
¹² Giwa, S., Lewis, J., Alvarez, L. et al. The promise of organ and tissue preservation to transform medicine. Nat Biotechnol 35, 530–542 (2017). https://doi.org/10.1038/nbt.3889
¹³ Dhital, K. K. et al. Adult heart transplantation with distant procurement and ex-vivo preservation of donor hearts after circulatory death: a case series. Lancet 10.1016/S0140-6736(15)60038-1
9