O transplante cardíaco heterotópico teve como pioneiro o Dr. Christiaan Barnard em 1974 (pioneiro também do transplante cardíaco ortotópico, realizado em 3 de dezembro de 1967), tendo as seguintes indicações: pacientes com hipertensão pulmonar; suporte circulatório sistêmico do coração nativo em caso de falha primária do enxerto; e suporte circulatório cardíaco nativo durante rejeição grave (isso na década de 1970, quando a rejeição aguda era a principal causa de morte). Desde então, outras duas indicações foram incluídas: doadores de coração pequeno, isto é, quando há uma diferença no tamanho do coração entre o doador – significativamente menor – e o receptor; e doadores com coração comprometido, ou seja, quando houve isquemia prolongada e grandes riscos de complicações1. De acordo com a 3ª Diretriz Brasileira de Transplante Cardíaco, o método heterotópico é indicado estritamente aos casos de coração pequeno do doador e receptor com hipertensão pulmonar acentuada2.
Técnica cirúrgica de Barnard
A técnica de Barnard no transplante cardíaco heterotópico consistia no coração do doador em paralelo ao nativo, do receptor1. Portanto, inicia-se com uma anastomose do átrio esquerdo do doador com o do receptor e o átrio direito do doador é anastomosado tanto com a câmara correspondente do receptor quanto com a veia cava superior deste2. Em seguida, é realizada uma anastomose término-lateral da aorta ascendente do doador com a do receptor, sendo finalizado com a sutura do tronco arterial pulmonar do doador com o do receptor, porém interposto com tubo de Dacron que serve como extensão pois, sem este, a união dos troncos das artérias pulmonares somente seria possível à custa de tensão ou até mesmo impossível pela falta de comprimento tecidual do doador (Figura 1 e Vídeo 1)3. Há relatos de que a técnica de Barnard fazia com que o coração doado assumisse toda a função hemodinâmica, enquanto o coração doente, nativo, ficava sem atividade – tornando-se um grande foco de formação de trombos, endocardite e arritmia, culminando no desuso dessa técnica4.
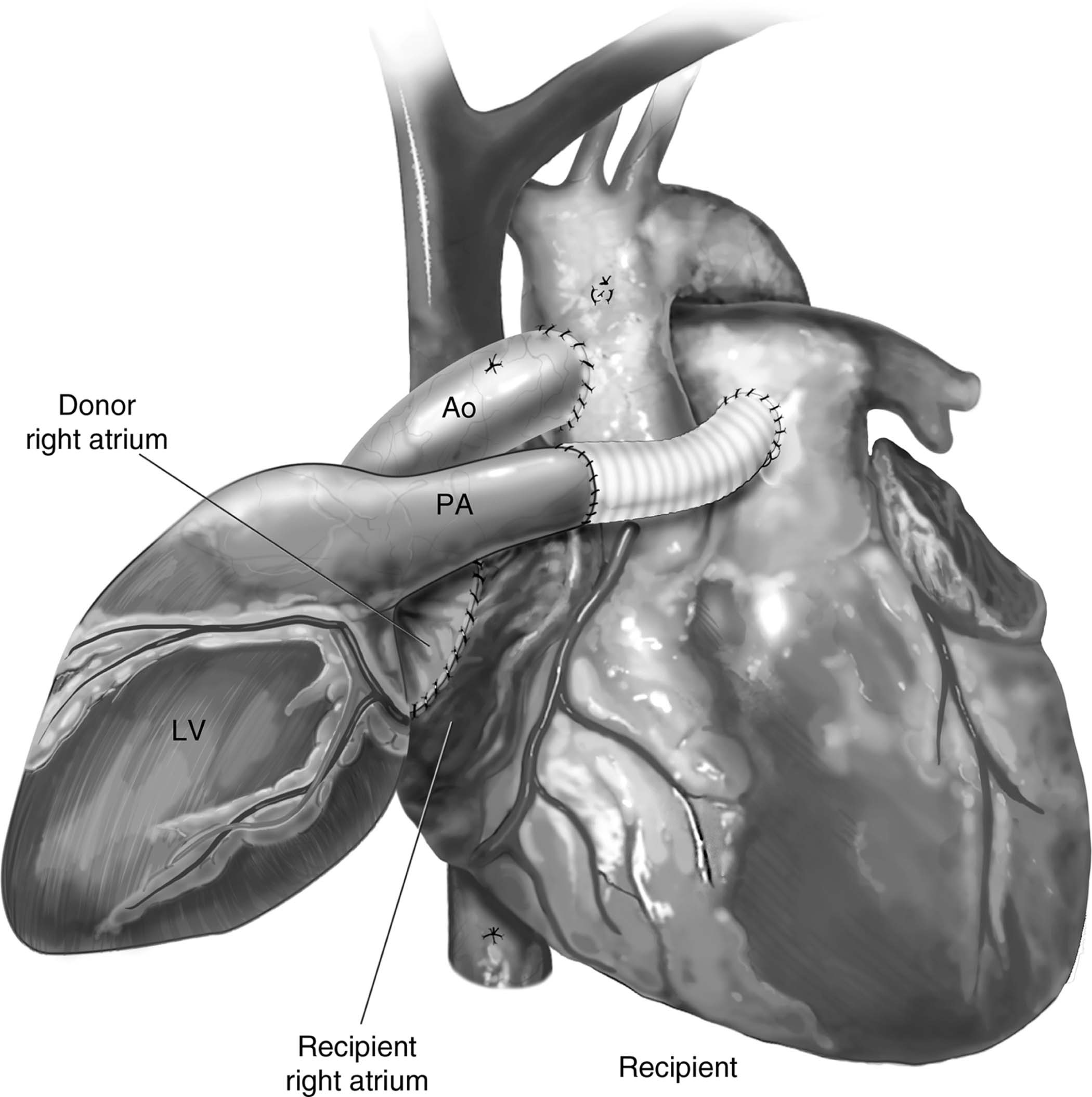
Figura 1 – Aspecto final do transplante cardíaco heterotópico pela técnica de Barnard, sendo possível evidenciar o tubo de Dacron interposto entre os troncos das artérias pulmonares do doador e do receptor. Ao: aorta; LV: ventrículo esquerdo; PA: tronco da artéria pulmonar.
Fonte: Copeland J, Copeland H1.
Vídeo 1 – Transplante cardíaco heterotópico realizado pela técnica de Barnard.
Fonte: José Wanderley Neto, MD. (cortesia)
Técnica cirúrgica de Copeland
A técnica cirúrgica de Copeland é uma modificação da técnica anterior e funciona como uma assistência ventricular esquerda biológica a partir de quatro anastomoses3,5. Na retirada do coração doado, é necessário retirar também um comprimento extra da porção ascendente da artéria aorta, sendo o tamanho determinado no transoperatório, bem como um comprimento extra da veia cava superior a fim de estabelecer um caminho futuro para biópsias cardíacas do pós-transplante (Figura 2)1. Além disso, o coração é retirado com as veias pulmonares, sendo suturadas as veias superior e inferior esquerdas, bem como a veia cava inferior, com fio polipropileno 4-0 e os óstios das veias pulmonares superior e inferior direitas são unidos através de incisão longitudinal, que é alargada com extensão no ponto médio do septo atrial (Figura 3)5. No preparo do receptor, a pleura direita é aberta amplamente e o pericárdio direito é aberto posteriormente em direção ao nervo frênico direito em três localizações: ao nível do diafragma, na porção mais cefálica e ao lado direito no ponto médio entre as extremidades, no intuito de criar um espaço sem tensão para a anastomose dos átrios esquerdos, permitindo que o enxerto cardíaco se pendure gentilmente no hemitórax direito sem estrangulamento pelo pericárdio (Figura 4)1,5. O coração nativo recebe canulação bicaval e são colocadas fitas de veia cava em ambas, além de canulação aórtica levemente distal, hipotermia sistêmica moderada em circulação extracorpórea (CEC) a 32ºC e cardioplegia padrão, com a aorta sendo clampeada (Figura 5)1.
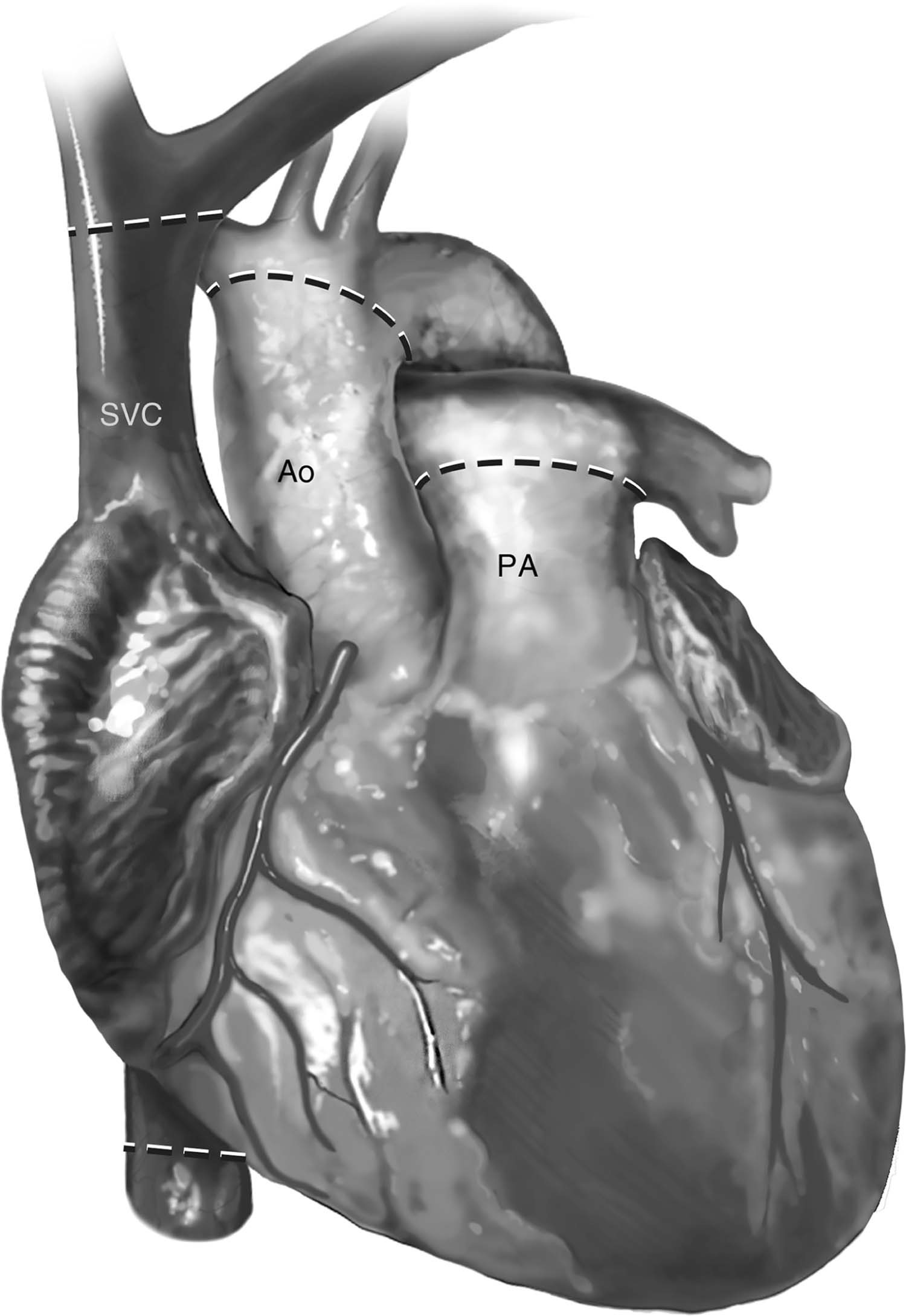
Figura 2 – As linhas tracejadas demonstram os níveis para corte dos vasos do receptor. Ao: aorta ascendente; PA: tronco da artéria pulmonar; SVC: veia cava superior.
Fonte: Copeland J, Copeland H1.
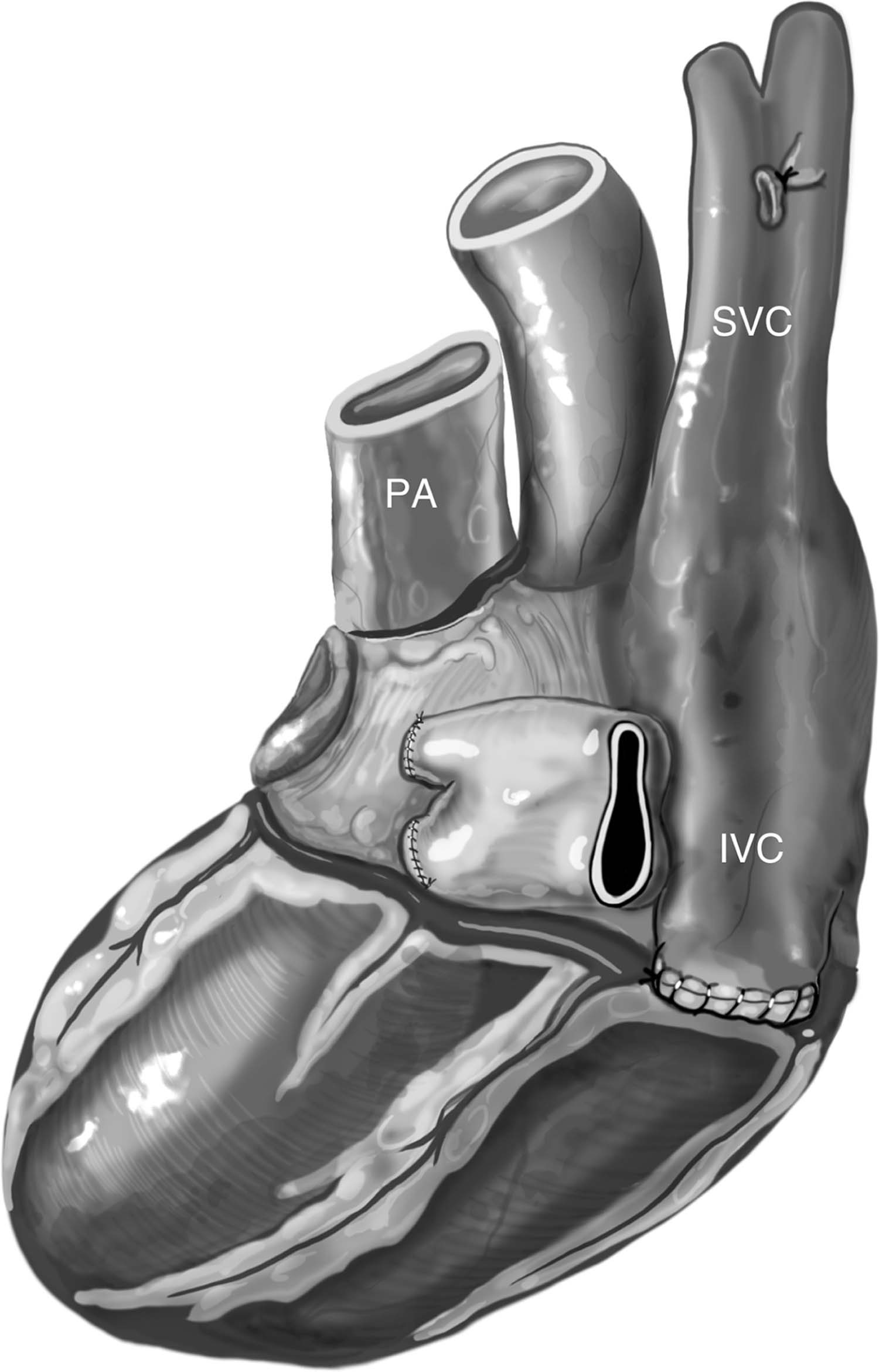
Figura 3 – Visão da face diafragmática do coração e de sua base, evidenciando as suturas das veias pulmonares superior e inferior esquerdas e da veia cava inferior com fio polipropileno 4-0, bem como o resultado da união dos óstios das veias pulmonares superior e inferior direitas. Nota-se também a sutura da veia ázigos. IVC: veia cava inferior; PA: tronco da artéria pulmonar, SVC: veia cava superior.
Fonte: Copeland J, Copeland H1.
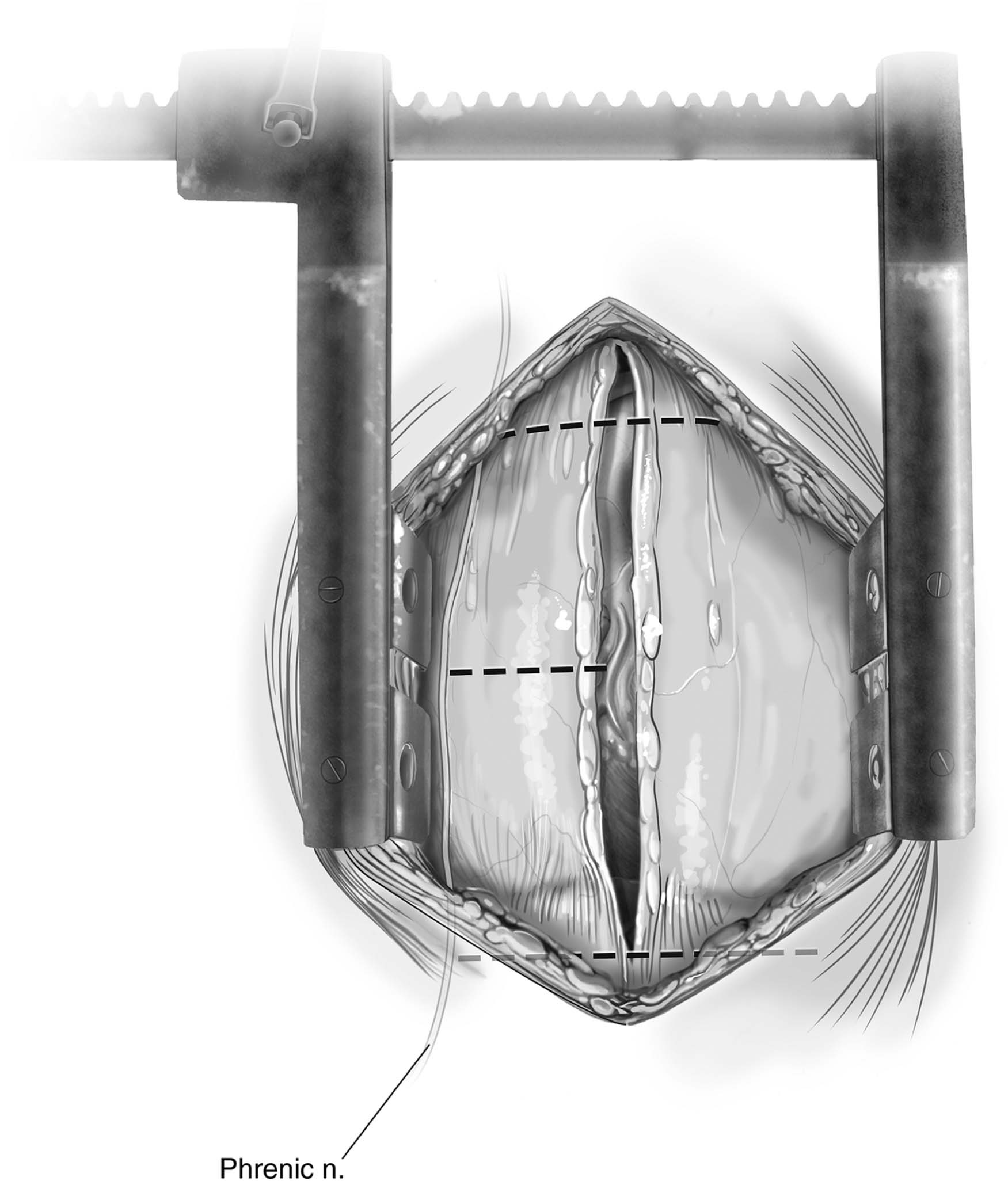
Figura 4 – Incisão do pericárdio e linhas tracejadas indicando as novas incisões. O nervo frênico direito pode ser evidenciado na imagem, aderido ao pericárdio fibroso.
Fonte: Copeland J, Copeland H1.
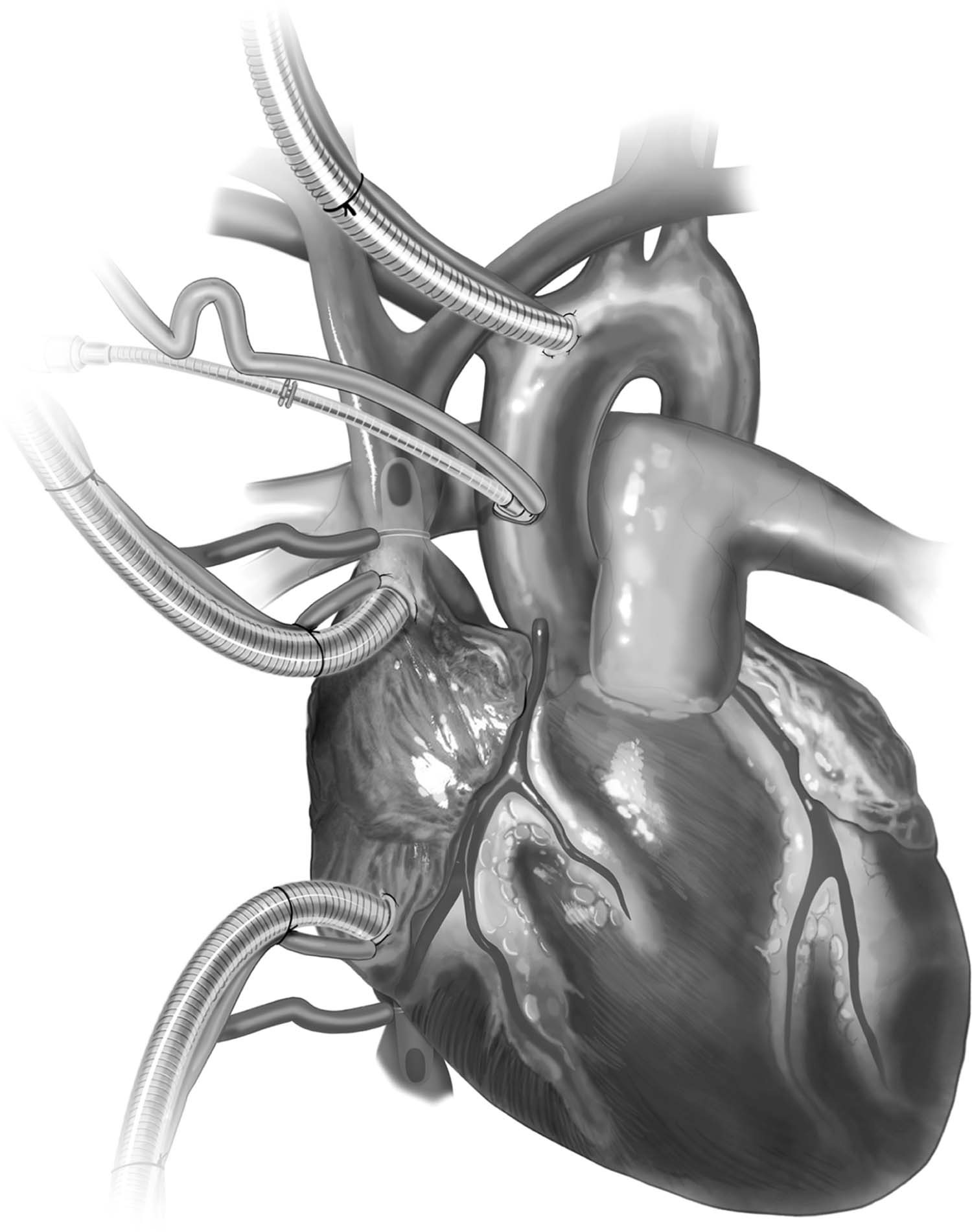
Figura 5 – Canulação bicaval em evidência, com as cânulas em transparência no começo das cavas, além da canulação mais distal na aorta e do uso de solução cardioplégica.
Fonte: Copeland J, Copeland H1.
A primeira anastomose feita é entre os átrios esquerdos a partir da atriotomia esquerda do doador e da grande incisão no coração nativo, próxima e paralela ao sulco de Waterston (sulco entre os átrios, na base do coração), realizando uma sutura contínua com fio polipropileno 3-0 e agulha SH a fim de realizar uma grande anastomose, evitando o “efeito de bolsa” (Figura 6)1,5. Agora, o acesso ao teto do pericárdio é essencial e um relaxamento maior do pericárdio direito é indicado em qualquer indício de que possa estreitar a via do átrio esquerdo nativo para o átrio esquerdo doado, não devendo haver gradiente nessa anastomose na saída da CEC1.
Em seguida, é realizada uma incisão linear longitudinal um pouco menor que a extremidade oblíqua cortada da aorta do doador, geralmente iniciando com lâmina 11 e estendendo a incisão com uma tesoura Potts, prosseguindo com anastomose término-lateral aorto-aórtica utilizando fio polipropileno 4-0 e agulha BB para sutura (Figura 7)1. Após a conclusão dessa anastomose, são feitas punções com agulha de calibre 20 no ponto mais alto e anterior de cada aorta, promovendo fluxo sanguíneo e saída efetiva de ar, sendo então fechadas com fio polipropileno 4-01. O clamp aórtico é removido e o paciente é posto em posição de Trendelenburg íngreme, iniciando também desfibrilação (ressuscitando ambos corações), ventilação vigorosa e ecocardiograma transesofágico, concomitantemente ao reaquecimento do paciente, precedendo a saída da CEC1.
O transplante prossegue com uma incisão na parede livre do átrio direito de tamanho igual ao diâmetro da extremidade do tronco da artéria pulmonar do doador e é feita uma anastomose término-lateral entre este e a parede livre do átrio direito do receptor através de sutura com fio polipropileno 4-0 ou 5-0 com agulha C11. Essa anastomose promove descompressão do lado direito do coração doado ao esvaziar o retorno venoso do seio coronário e é opção para via de biópsia do ventrículo direito do doador (Figura 8)1,5.
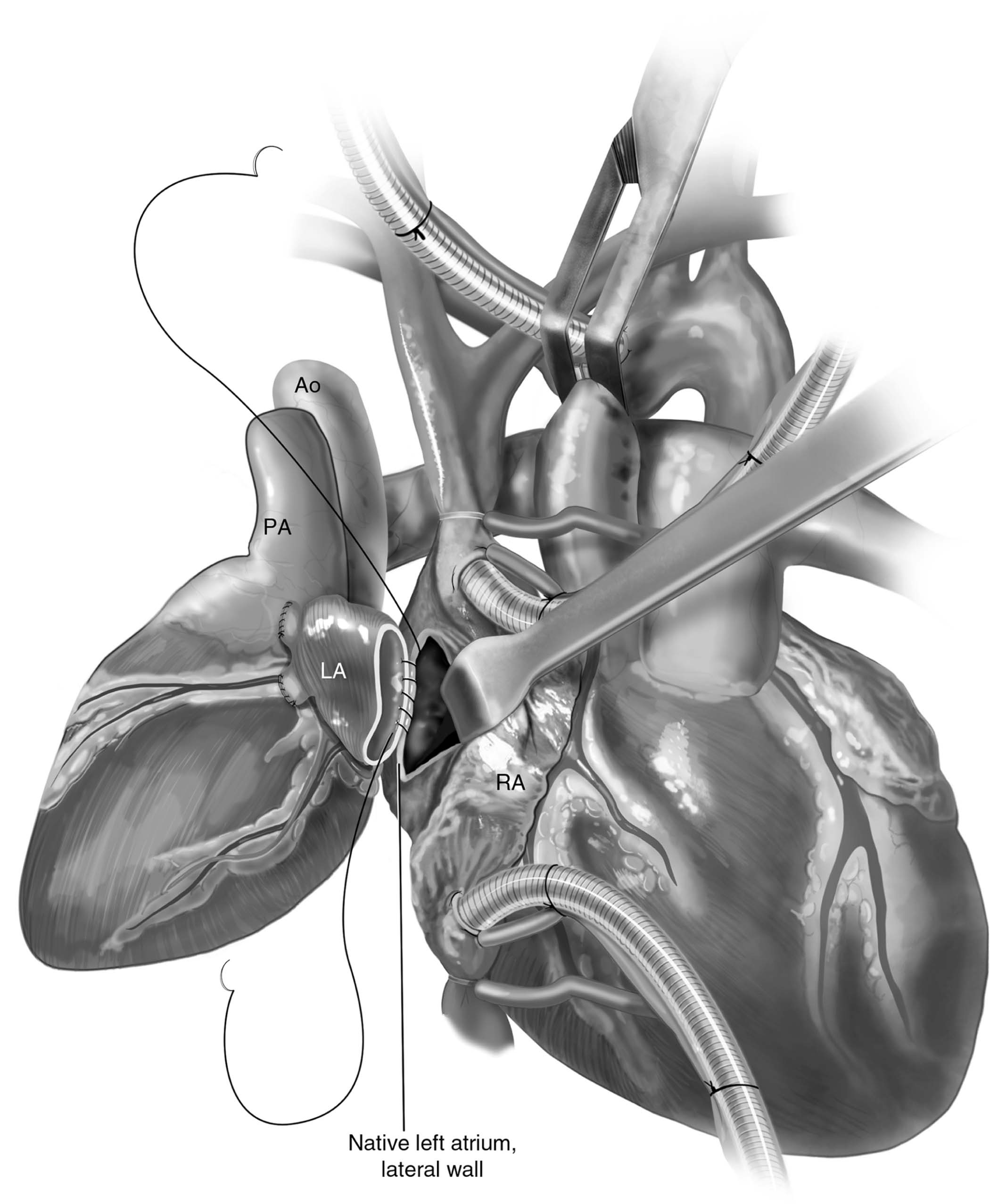
Figura 6 – Anastomose entre os átrios esquerdos. Átrio esquerdo do receptor com incisão paralela e próxima ao sulco de Waterston e sutura contínua com fio polipropileno 3-0
e agulha SH para realizar grande anastomose e evitar o “efeito de bolsa”. Ao: aorta ascendente; LA: átrio esquerdo; PA: tronco da artéria pulmonar; RA: átrio direito.
Fonte: Copeland J, Copeland H1.
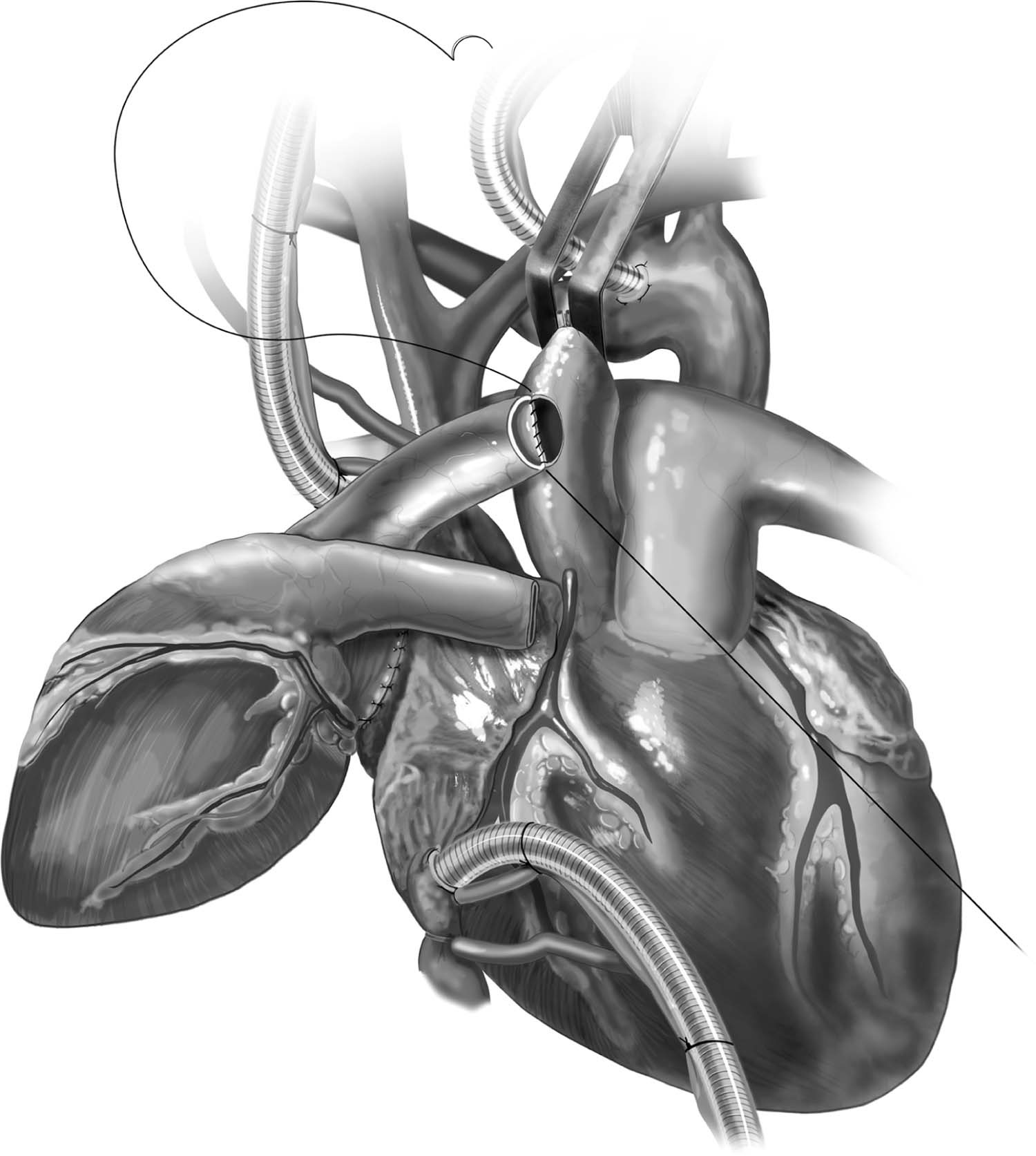
Figura 7 – Anastomose término-lateral aorto-aórtica com fio polipropileno 4-0 e agulha BB.
Fonte: Copeland J, Copeland H1
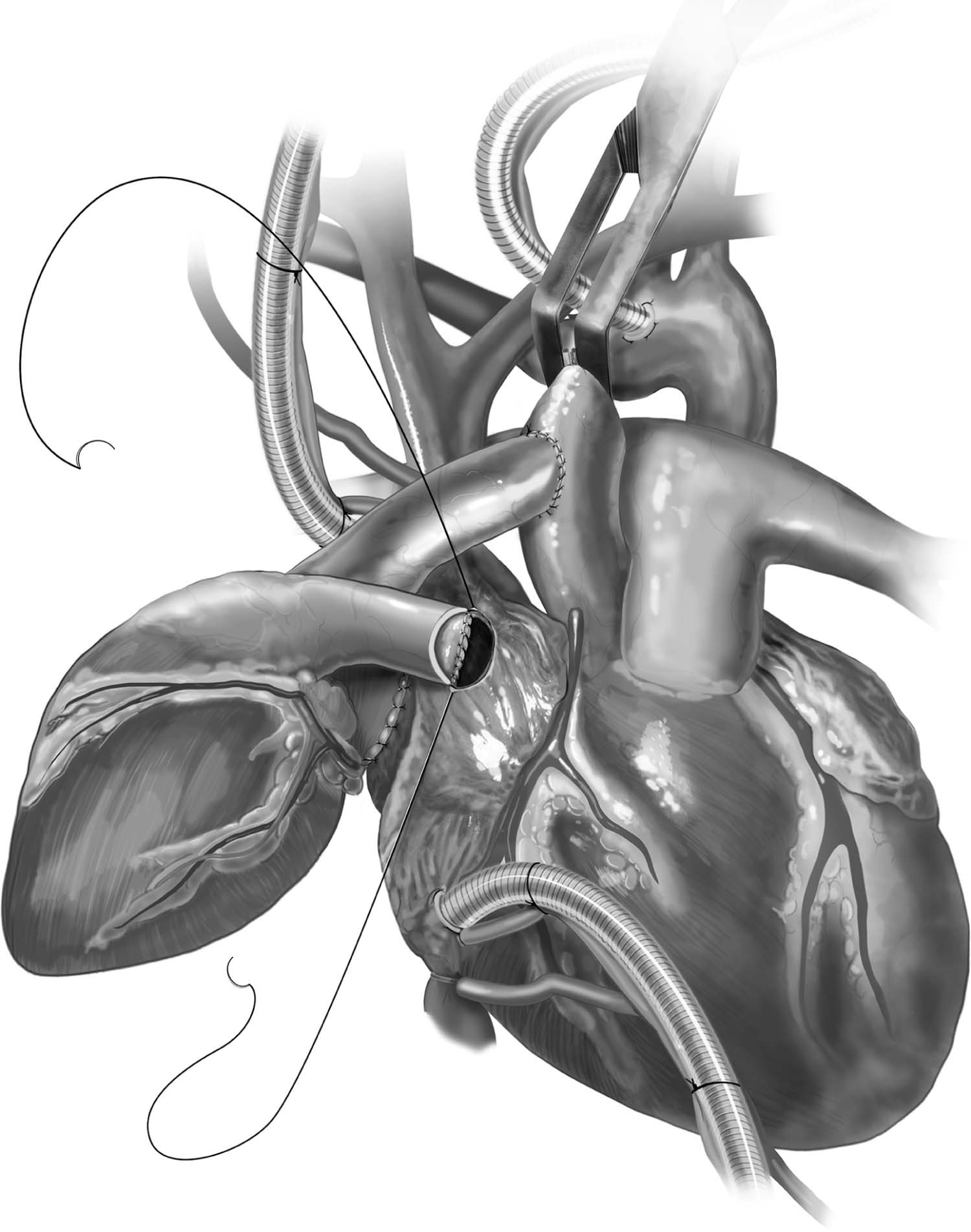
Figura 8 – Anastomose término-lateral entre o tronco da artéria pulmonar do doador e a parede livre do átrio direito do receptor com fio polipropileno 4-0 ou 5-0 e agulha C1, promovendo descompressão do coração doado e esvaziando o retorno venoso do seio coronário.
Fonte: Copeland J, Copeland H1.
É realizada, então, uma anastomose término-lateral entre as veias cavas superiores do doador e receptor grande o suficiente para ser acomoda pelo tamanho da veia cava superior do doador e pela disponível do receptor para criar um caminho de futuras biópsias endomiocárdicas utilizando fio de polipropileno 5-0 e agulha C1, além da marcação com quatro clipes metálicos ao redor da anastomose como marcadores para guiar futuras biópsias cardíacas através da veia jugular interna direita sob fluoroscopia (Figura 9A, 9C e 10)1,5. Um possível problema dessa anastomose é a presença de vários fios de marcapasso e desfibrilação previamente implantados e que são associados à alguma fibrose de veia cava superior e, sendo assim, é importante a escolha de um local favorável e diferentes locais da veia cava superior nativa podem ser considerados, a exemplo do corpo do átrio direito, sempre objetivando uma entrada amplamente patente para biópsias futuras1. Assim como na anastomose entre o tronco da artéria pulmonar e o átrio direito do receptor, a anastomose entre as veias cavas superiores já sucedeu a retirada do clamp da aorta e também é feita sob posição de Trendelenburg (Figura 9B).
A desfibrilação pode ser necessária, sendo aplicada diretamente em cada coração com as pás em cada lado dos respectivos ventrículos, no intuito de otimizar a condução elétrica transmiocárdica (geralmente de 5 a 20 Joules para cada coração)1. Ambos corações devem ser agitados com elevação de seus ápices para que seja inserida agulha de calibre 20 e seringa de 10 mL para aspirar o ar e são fechados os locais de punção de cada ápice com fio polipropileno 3-0, e a presença de ar retido é avaliada pelo ecocardiograma transesofágico1.
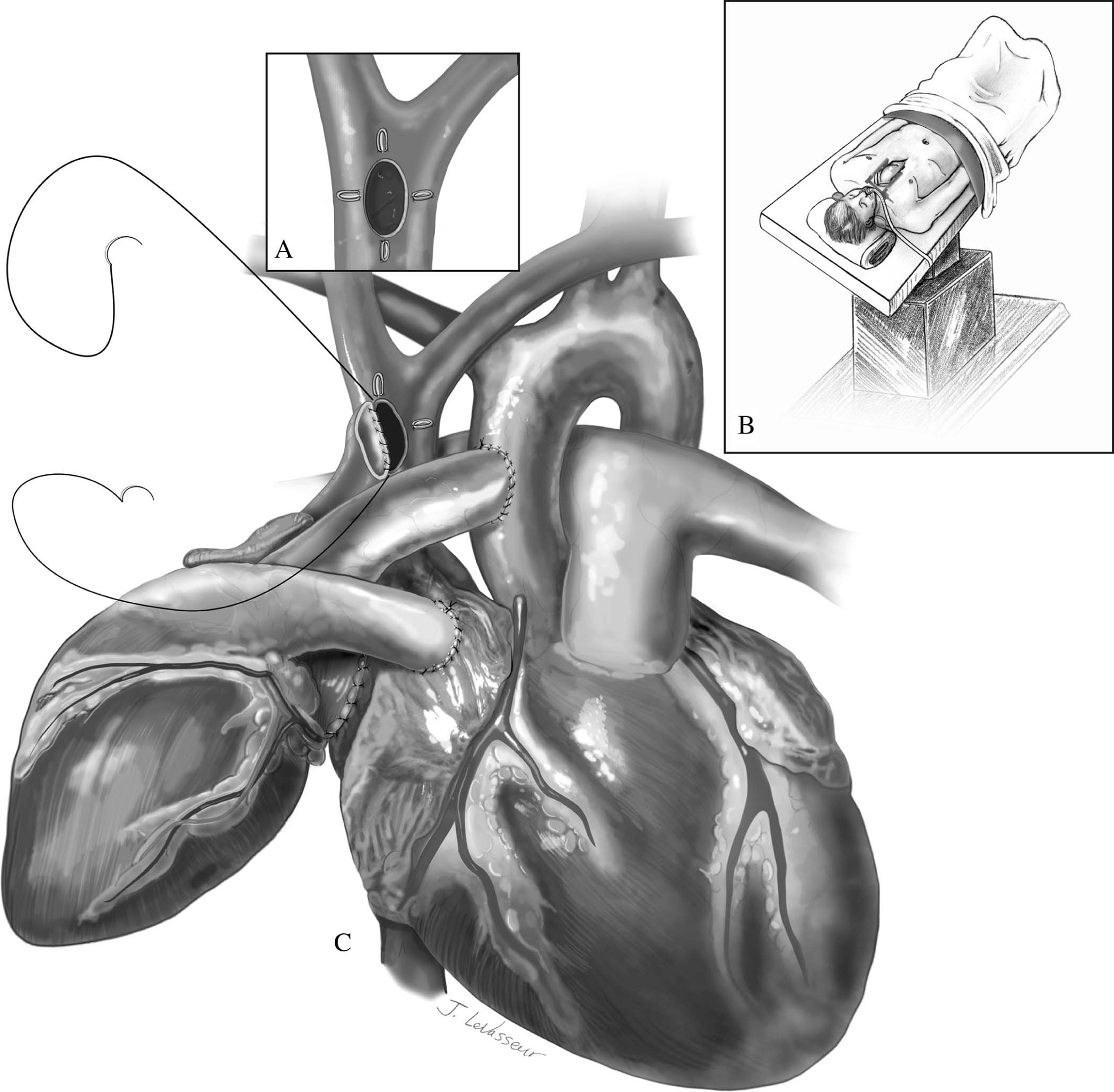
Figura 9 – Incisão na veia cava superior do receptor com os quatro clipes metálicos em evidência (A). Receptor em posição de Trendelenburg (B) e anastomose término-lateral entre as veias cavas superiores do doador e receptor com fio polipropileno 5-0 e agulha C1 (C).
Fonte: Copeland J, Copeland H1.
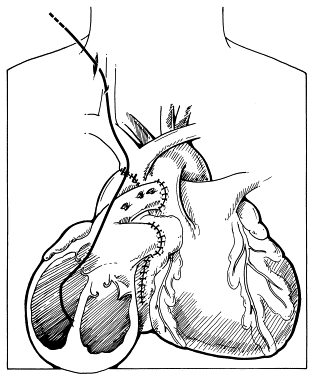
Figura 10 – Trajeto percorrido para biópsia endomiocárdica desde a veia jugular interna direita até o septo interventricular no ventrículo direito.
Fonte: Copeland H, Copeland J3.
Uma vez implantado, o coração doado fica próximo ao receptor e é o momento de avaliar as anastomoses, a posição do enxerto, se há algum efeito do pericárdio direito (podendo realizar mais relaxamento, caso necessário), a relação com o pulmão direito e, o mais importante, a função do ventrículo esquerdo do doador e a função do ventrículo direito do receptor (Figura 11)1. O desmame da CEC só é buscado após a retirada de todo o ar retido e são realizadas manobras, a exemplo da diminuição do fluxo da CEC por 1 a 2 minutos, consequentemente aumentando o volume e permitindo que ambos corações bombeiem com os pulmões hiperinsuflados, visando à retirada de todo ar venoso pulmonar1. São gastos em torno de 30 minutos com a remoção do ar, o que possibilita uma avaliação completa a respeito do posicionamento e da função do enxerto heterotópico1.
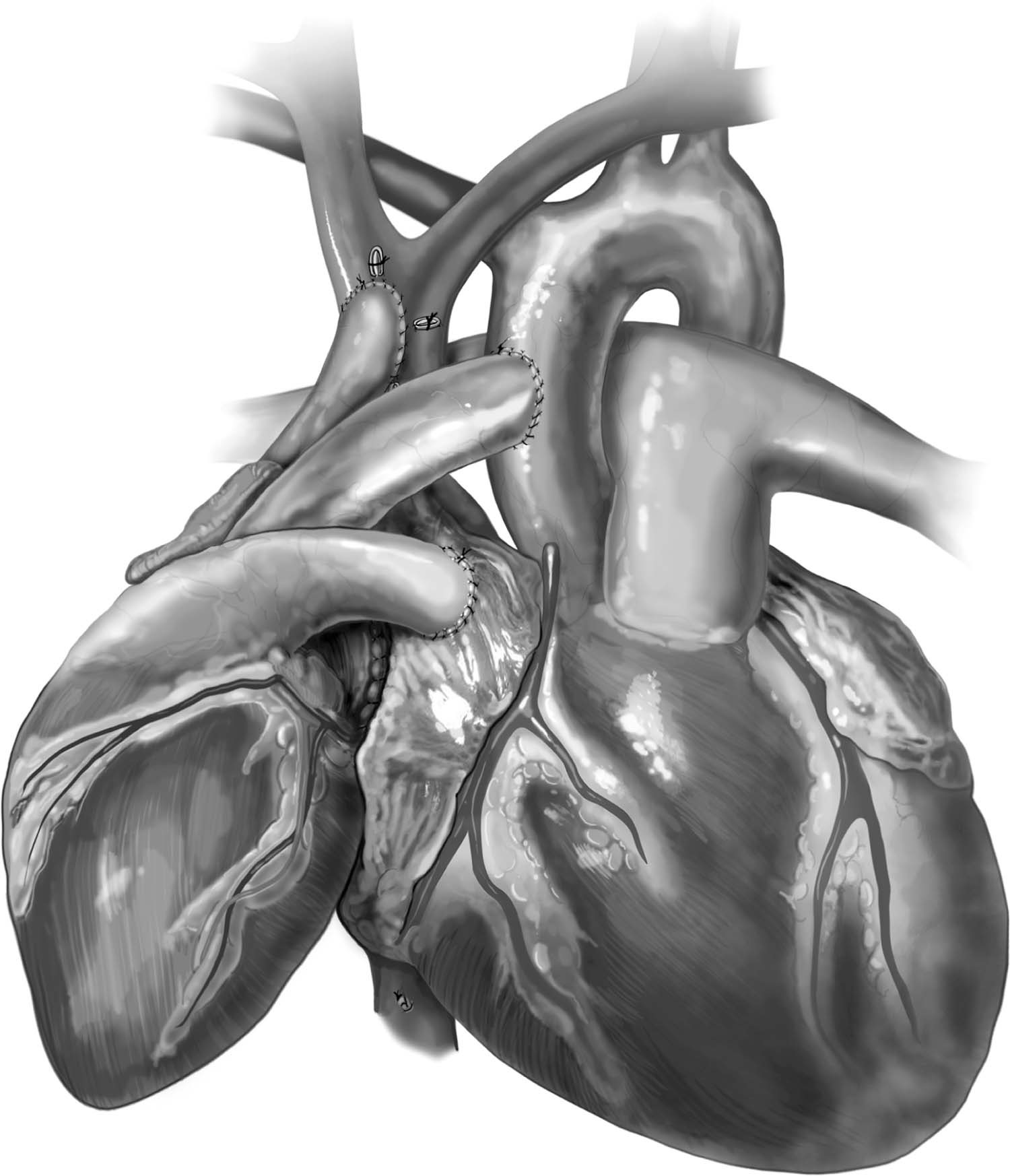
Figura 11 – Aspecto final do transplante cardíaco heterotópico modificado pela técnica de Copeland.
Fonte: Copeland J, Copeland H.1
Resultados e perspectivas
O transplante cardíaco heterotópico surge como opção valiosa no tratamento de pacientes com hipertensão pulmonar grave e/ou fixa e resistência vascular pulmonar grave na ausência de insuficiência ventricular direita do receptor, promovendo melhora sintomática nos receptores e beneficiando inclusive os candidatos ao suporte circulatório mecânico, minimizando suas complicações e aumentando a sobrevida a curto prazo3. Vale ressaltar que pacientes submetidos a essa técnica seguem com os mesmos esquemas de imunossupressão e rotina de biópsia pós-transplante3. Ainda é difícil determinar se o transplante cardíaco heterotópico aumentaria o pool de doadores utilizando corações de tamanho incompatível, porém é uma poderosa alternativa se os doadores não forem marginais (aqueles que precisavam de grande suporte inotrópico, com histórico de parada cardíaca ou arritmia, anormalidade na mobilidade da parede ao ecocardiograma e/ou mudanças isquêmicas ao eletrocardiograma) e não fossem realizados em receptores abaixo do ideal3.
No Instituto do Coração do Hospital das Clínicas da Faculdade de Medicina da Universidade Federal de São Paulo, há uma pesquisa em andamento liderada pelo professor doutor Fábio Antônio Gaiotto, chefe do departamento de transplante cardíaco do hospital, sobre a reoperação de pacientes submetidos a transplante cardíaco heterotópico pela técnica de Copeland em que se retira o coração nativo e se enxerta unicamente o coração do doador, uma vez que já houve redução da hipertensão pulmonar4.
Dr. Jack Copeland responde ao blog
“Caro Antonio, em muitos casos o suporte ventricular esquerdo do coração doado pode ser suficiente (Figura 12). Essa é uma técnica útil para 1. Pessoas ou sistemas de saúde que não podem custear um dispositivo de assistência ventricular esquerda (LVAD) mecânico; 2. Pacientes sem insuficiência no coração esquerdo que foram negados ao transplante cardíaco devido à hipertensão pulmonar; 3. Incompatibilidade de tamanho entre doador-receptor com doador pequeno; 4. Coração doado de maior risco. Barnard originou a técnica por causa da ameaça severa de rejeição aguda do doador. Sua ideia era que o próprio coração do receptor suportaria o paciente até que a rejeição fosse tratada.”
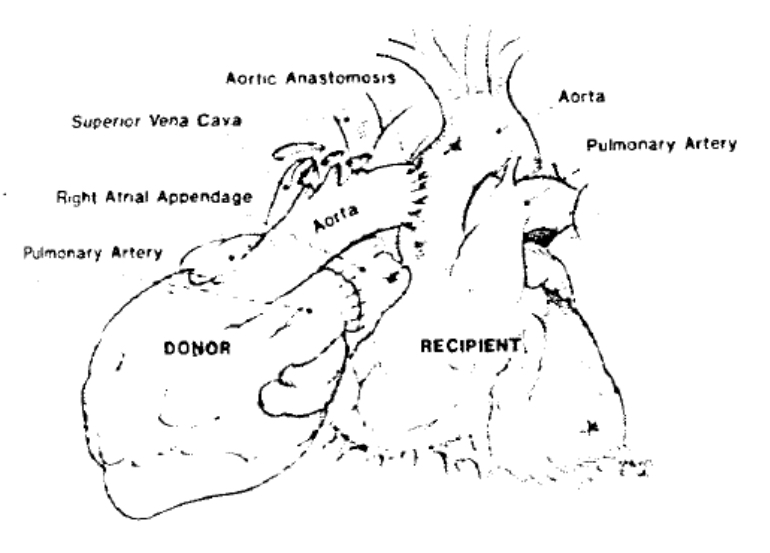
Figura 12 – Técnica de transplante cardíaco heterotópico modificada.
Fonte: Jack Copeland, MD. (cortesia)
Referências
- Copeland J, Copeland H. Heterotopic heart transplantation: technical considerations. Oper Tech Thorac Cardiovasc Surg. 2016;21(3):269-80. doi: 10.1053/j.optechstcvs.2017.05.004. Disponível em: https://www.sciencedirect.com/science/article/pii/S1522294217300132
- Bacal F, Marcondes-Braga FG, Rohde LEP, Xavier Júnior JL, de Souza Brito F, Moura LZ, et al. 3ª Diretriz Brasileira de Transplante Cardíaco. Bras. Cardiol. 2018; 111(2):230-289. doi: 10.5935/abc.20180153. Disponível em: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0066-782X2018001400230&lng=en&nrm=iso
- Copeland H, Copeland J. Heterotopic heart transplantation. 2018. doi: 10.5772/intechopen.74582. Disponível em: https://www.intechopen.com/books/heart-transplantation/heterotopic-heart-transplantation
- 11º Virtual Meeting – Transplante cardíaco – Dr. Fábio Gaiotto. 2018. Disponível em: https://www.youtube.com/watch?v=8ongxngR_hc
- Copeland H, Kalra N, Gustafson M, Coelho-Anderson R, Friedman M, Copeland JG. A case of heterotopic heart transplant as a “biologic left ventricular assist” in restrictive cardiomyopathy. World J Pediatr Congenit Heart Surg. 2011. doi: 1177/2150135111411588. Disponível em: https://www.ncbi.nlm.nih.gov/pubmed/23804478