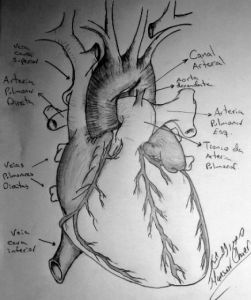
Figura 1. Desenho anatômico do canal arterial.
Fonte: cortesia do Dr. Mansuor Chaer Alameddin para esta publicação.
O canal arterial é um conduto vascular músculo-elástico que, no arco aórtico à esquerda típico, permite uma comunicação entre o istmo da aorta e o teto da bifurcação do tronco da artéria pulmonar, possibilitando que, através dele, a maior parte do débito do ventrículo direito alcance a circulação sistêmica ao ser desviado do leito vascular pulmonar. Em pacientes com arco aórtico à direita, o ducto geralmente surge a partir dos vasos braquiocefálicos esquerdos em vez de na aorta descendente. No feto, o ventrículo direito acomoda aproximadamente 60% do débito cardíaco total¹. A vasculatura pulmonar é contraída, resultando em uma alta resistência vascular dentro do leito pulmonar. Por outro lado, a placenta cria um leito de pouca resistência na aorta e a resistência vascular sistêmica é baixa. Como resultado, a maioria do sangue que sai do ventrículo direito passa da direita para a esquerda através do canal arterial para a aorta descendente e para a placenta.
Os registros históricos creditam o termo “ductus arteriosus” a Leonardus Botallus, médico italiano que descreveu a circulação fetal no século XV. Em 1900, Gibson relatou os aspectos clínicos e patológicos da persistência do canal arterial e descreveu seu sopro contínuo característico, que carrega seu nome como epônimo.
Se após o nascimento não houver a oclusão do canal arterial, o sangue, por diferença de pressão, passará da aorta para a artéria pulmonar, podendo gerar hipertensão arterial pulmonar, insuficiência cardíaca na criança e doença pulmonar vascular obstrutiva na idade adulta².
O tecido ductal difere histologicamente do tecido da aorta adjacente e da pulmonar, tendo uma camada íntima mais espessa e uma camada média com fibras musculares lisas dispostas em espiral³.
A patência do ducto na vida fetal é mantida pelo baixo conteúdo de oxigênio arterial e pelos níveis de prostaglandina E2 circulante (PGE2), que é produzida em parte pela placenta⁴. O papel das prostaglandinas na manutenção da patência do canal arterial fornece a justificativa para o uso de inibidores da síntese de prostaglandinas (p. ex., indometacina e ibuprofeno) no tratamento farmacológico da persistência do canal arterial. As complicações com o uso de indometacina e ibuprofeno podem envolver tendência a sangramento por disfunção plaquetária, disfunção renal com diminuição da diurese, enterocolite necrotizante e disfunção cardíaca transitória².
Com o início da respiração após o parto, os pulmões se expandem e a saturação sistêmica de oxigênio aumenta, resultando em vasodilatação pulmonar com consequente queda na resistência vascular pulmonar. Concomitantemente, a resistência sistêmica aumenta com a remoção da placenta após o corte do cordão umbilical. Esses fatores levam a uma reversão repentina do fluxo sanguíneo no canal arterial, que passa a ser da esquerda para a direita. O aumento da resistência vascular sistêmica e a diminuição dos níveis circulantes de PGE2 desencadeiam a constrição ductal.
Após o parto, os níveis circulantes de PGE2 caem por causa da produção reduzida após a remoção da placenta e pelo aumento da depuração de PGE2, principalmente no pulmão, decorrente do aumento nos níveis circulantes de prostaglandina desidrogenase⁵. Essa diminuição nos níveis de PGE2 é detectada pelos receptores no canal, removendo o forte efeito dilatador dessa prostaglandina e promovendo maior constrição ductal.
O fechamento do canal arterial geralmente ocorre em dois estágios, iniciando com um fechamento hemodinâmico funcional por contração da musculatura lisa que ocorre dentro de 10 a 15 horas após o parto⁶. O fechamento geralmente começa na extremidade pulmonar do ducto e prossegue em direção à extremidade aórtica, tipicamente se completando na segunda ou terceira semana de vida. Após uma constrição inicial, sucessivas alterações histológicas resultam na obliteração do ducto e em sua conversão no ligamento arterioso: separação das células endoteliais da lâmina elástica interna, resultando em uma ampla região de edema subendotelial; crescimento de células endoteliais e migração de células musculares lisas indiferenciadas do meio interno para a região subendotelial; aposição de células endoteliais que limitam o lúmen; e alterações degenerativas. Essas alterações não ocorrem no canal arterial persistente. As células endoteliais permanecem estreitamente aderidas à lâmina elástica interna e o meio subjacente é de estrutura anormal. No caso do canal arterial persistente parcial, os tipos de parede normal e anormal são encontrados em um único canal arterial⁷.
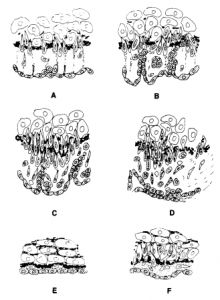
Figura 2. Desenho esquemático das mudanças histológicas da parede normal (A-D) e anormal (E-F). (A) Desenvolvimento de edema. (B) Desdobramento das células endoteliais com edema mais acentuado e protusão de células do meio interno para o meio subendotelial. (C) Infiltração da região subendotelial com vários tipos celulares. (D) Início de alterações degenerativas e acúmulo de gotículas lipídicas. (E) Não há desenvolvimento de edema. (F) Pequeno edema sem dobra celular.
Fonte: Gittenberger-de Groot et al..
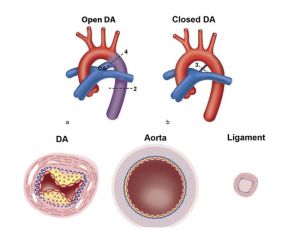
Figura 3. Análise estrutural do canal arterial.
Fonte: Bökenkamp et al.⁸.
A incidência da persistência do canal arterial entre bebês a termo varia de 3 a 8 por 10.000 nascidos vivos⁹. Há uma predominância feminina na persistência do canal arterial, com uma proporção de 2:1 de meninas para meninos na maioria dos casos de bebês a termo¹⁰. Foi enxergada, também, maior incidência na presença de rubéola congênita.
Um dos fatores de risco mais importantes para a persistência do canal arterial é a prematuridade. Nos bebês a termo, geralmente há fechamento hemodinâmico funcional do ducto em 50% das crianças nas 24 horas após o nascimento, em 90% nas 48 horas e em praticamente todos os pacientes após 72 horas¹¹. Já nos bebês pré-termo, o fechamento do canal arterial é tardio e o risco de o ducto permanecer patente é inversamente proporcional à idade gestacional.
As alterações histológicas características após a oclusão funcional do canal arterial ocorrem rapidamente em bebês a termo, porém, em prematuros, o ducto pode reabrir após o fechamento que ocorre espontaneamente ou após o tratamento farmacológico¹². A reabertura do canal arterial provavelmente tem sua explicação nos mesmos mecanismos da prematuridade que suprimem a resposta ductal a fatores que promovem constrição inicial no momento do parto. Um estudo com 77 pacientes pré-termo que tiveram fechamento completo do canal arterial após tratamento com indometacina verificou que em 23% dos casos houve reabertura de um canal arterial significativo¹³. A taxa de reabertura aumentou com a diminuição da idade gestacional, ocorrendo com maior frequência em bebês com menos de 27 semanas de gestação do que nos bebês com 27 a 33 semanas.
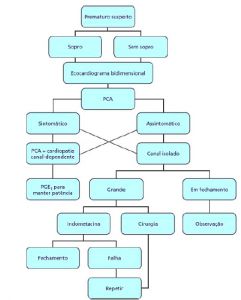
Figura 4. Fluxograma do manejo de pacientes pré-termo com suspeita de persistência do canal arterial.
Fonte: Silva LPRG, Bembom MC, Silva MFAG, Silva PAG. Persistência do canal arterial.
In:Croti UA, Mattos SS, Pinto Jr. VC, Aiello VD, Moreira VM. Cardiologia e cirurgia
É bastante provável que fatores genéticos contribuam para alguns casos de persistência do canal arterial, visto que irmãos de pacientes acometidos têm uma frequência aumentada dessa anormalidade. O canal arterial persistente ocorre ocasionalmente em muitos membros de várias gerações de uma família, tornando provável a herança autossômica dominante simples nessas famílias¹⁴.
As manifestações clínicas de um canal arterial persistente são determinadas pelo grau de desvio do shunt esquerda-direita. O grau do desvio depende do tamanho e do comprimento do canal e da diferença entre as resistências vasculares pulmonares e sistêmicas. Com base na razão fluxo pulmonar/fluxo sistêmico (Qp:Qs), podemos caracterizar o grau do desvio da esquerda para a direita¹⁵. Tem-se um desvio pequeno quando a relação Qp:Qs é < 1,5, moderado quando entre 1,5 e 2,2, e grande quando > 2,2.
Um canal arterial pequeno (Qp:Qs < 1,5), que restringe o hiperfluxo pulmonar potencial, pode não ser detectado e o paciente geralmente não apresenta sintomas identificáveis. O diagnóstico é comumente incidental pela detecção do sopro contínuo característico na ausculta cardíaca ou quando observado em um estudo diagnóstico indicado por outras condições clínicas (p. ex., tomografia computadorizada)¹⁶.
Quanto ao sopro no canal arterial pequeno, há características que o diferenciam no neonato e nos bebês mais velhos, tendo íntima relação com as diferenças relativas entre as resistências pulmonares e sistêmicas. No recém-nascido, a pressão sistólica da aorta é maior que a pressão sistólica da artéria pulmonar, porém esse gradiente pode não estar presente na diástole; dessa maneira, o sopro pode ser apenas sistólico. Após o período neonatal, a pressão da artéria pulmonar sofre um decréscimo, fazendo com que a pressão aórtica seja maior tanto na sístole quanto na diástole, produzindo um fluxo contínuo através do canal arterial, originando o sopro característico em maquinaria, também chamado de sopro de Gibson (Figura 5).
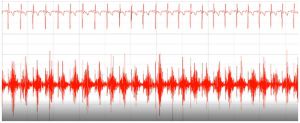
Figura 5. Relação entre o eletrocardiograma e o fonocardiograma na presença de canal arterial persistente.
Fonte: © 2020 UpToDate, Inc. and/or its affiliates. All Rights Reserved.
Na presença de um canal arterial de tamanho moderado (Qp:Qs entre 1,5 e 2,2 ), pode haver intolerância aos esforços. Nesses pacientes, ocorre desvio moderado da esquerda para a direita, cursando com aumento de volume no sistema esquerdo.
Um canal arterial grande (Qp:Qs > 2,2) causa inicialmente uma sobrecarga de volume no sistema esquerdo. Progressivamente, o aumento de pressões atinge a artéria pulmonar, que, no paciente sem correção, pode levar a alterações irreversíveis da vasculatura pulmonar. Com o aumento da resistência vascular pulmonar a ponto de superar o sistema esquerdo, o shunt agora será desviado da direita para a esquerda, e esses pacientes desenvolvem a síndrome de Eisenmenger.
O diagnóstico da persistência do canal arterial geralmente é baseado nos seus sinais e sintomas e é confirmado por uma análise ecocardiográfica. O eletrocardiograma e a radiografia de tórax podem ser úteis, porém têm menores sensibilidade e especificidade em relação ao ecocardiograma. Os achados na radiografia de tórax variam de acordo com o tamanho do canal e quanto ao desvio, em pacientes com canal arterial pequeno, a radiografia é normal. Já em um canal grande, podem ser vistos aumentos de átrio e ventrículo esquerdos, além de aumento da marcação da trama vascular pulmonar; é possível, também, que o tronco pulmonar esteja evidente. Um canal arterial grande geralmente produz achados eletrocardiográficos de hipertrofia biventricular. Na presença de hipertensão pulmonar de longa data, o desvio do canal é invertido (direita-esquerda) e predominam os sinais de hipertrofia do ventrículo direito. O cateterismo cardíaco e a angiografia geralmente são indicados quando se considera a terapia de oclusão percutânea ou no contexto de cardiopatia congênita mais complexa.
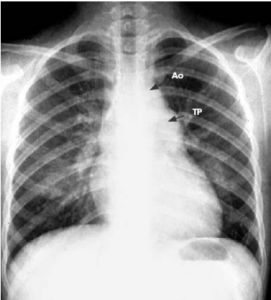
Figura 6. Arco aótico (Ao) e tronco pulmonar (TP) proeminentes.
Fonte: Silva LPRG, Bembom MC, Silva MFAG, Silva PAG. Persistência do canal arterial.
In:Croti UA, Mattos SS, Pinto Jr. VC, Aiello VD, Moreira VM. Cardiologia e cirurgia cardiovascular pediátrica. 2ª ed. São Paulo:Roca;2012. p. 661-72.
Pacientes com canal arterial persistente apresentam aumento de morbidade e mortalidade principalmente por insuficiência cardíaca e, mais raramente, por endocardite infecciosa¹⁷. Trinta por cento dos pacientes sintomáticos morrem no primeiro ano de vida e as causas são, em ordem decrescente de prevalência, insuficiência cardíaca, hipertensão pulmonar, pneumonia e endocardite infecciosa.
Um canal arterial grande não tratado pode gerar uma sobrecarga de volume significativa no coração, resultando em insuficiência cardíaca. Em pacientes cujas funções atrial e ventricular esquerda foram prejudicadas pelos efeitos da carga de trabalho crônica em volume podem apresentar insuficiência de crescimento, má alimentação e dificuldade respiratória. Em pacientes mais velhos, a insuficiência cardíaca está frequentemente associada à fibrilação atrial.
A endocardite infecciosa é uma complicação rara da persistência do canal arterial. Quando ocorre, as vegetações tipicamente se acumulam na extremidade pulmonar no ducto, com alto índice de embolia pulmonar séptica¹⁸. A maioria dos pacientes com persistência do canal arterial isolada não necessita de profilaxia com antibióticos para endocardite infecciosa.
A primeira tentativa de fechamento cirúrgico do canal arterial foi feita por Strieder em 1937, porém culminou com o falecimento do paciente por complicações clínicas. No ano seguinte, Gross e Hubbaid realizaram o primeiro fechamento bem-sucedido¹⁹.
A abordagem médica para oclusão do canal arterial segue basicamente três linhas: fechamento medicamentoso (limitado a pacientes pré-termo), fechamento cirúrgico e fechamento percutâneo, este desenvolvido e testado pela primeira vez por Portsmann em 1967. Na ausência de sintomatologia, a época ideal para fechamento é em torno do sexto mês de vida. Na ausência de doença vascular pulmonar, não existe contraindicação para o procedimento, mesmo em idade avançada. Em contrapartida, a doença vascular pulmonar obstrutiva grave contraindica o fechamento, sendo seguidos os critérios clássicos de inoperabilidade para pacientes com hiper-resistência pulmonar².
O fechamento do canal arterial deve ser indicado em todas as crianças ou adultos que apresentarem sintomas decorrentes do shunt esquerda-direita. Nos pacientes assintomáticos, porém com shunt significativo, que resulte em aumento do índice cardiotorácico, deve ser realizado o fechamento profilático pelo risco de complicações futuras, como a síndrome de Eisenmenger.
A mortalidade cirúrgica no tratamento cirúrgico da persistência do canal arterial é muito baixa, logo, a simples presença do canal arterial após o terceiro mês de vida já é indicação para o fechamento, o qual deve ser realizado preferencialmente no primeiro ano, antes do surgimento de repercussões importantes no tronco pulmonar².
As crianças no primeiro mês de vida e prematuros devem ser operados apenas quando apresentarem sinais de descompensação cardíaca e não responderem ao tratamento farmacológico. Nesses casos, a técnica cirúrgica deve ser preferencialmente extrapleural, visando ao fechamento do canal por meio de ligadura simples ou dupla, clipagem ou secção e sutura, obviamente excetuando-se os casos de presença de cardiopatia dependente do canal arterial para manutenção hemodinâmica. A manutenção do canal aberto pode ser feita pela infusão de prostaglandinas ou pela colocação de um stent no canal. O fechamento profilático em crianças prematuras e neonatos assintomáticos é controverso².
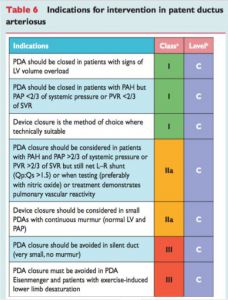
Figura 7. Indicações de intervenção no canal arterial persistente.
Fonte: Baumgartner et al.²º.
As bases do tratamento percutâneo consistem em basicamente cateterizar o canal arterial a partir tanto da aorta como do tronco pulmonar, a fim de posicionar uma prótese e fechar o canal. Diversas técnicas são usadas com o objetivo de estabilizar a prótese, visto que nas primeiras experiências com frequência ocorria deslocamento. Nos casos de canal arterial calcificado, com elevada resistência vascular, a oclusão percutânea apresenta vantagens ao fechamento cirúrgico². Para o fechamento de grandes canais, a prótese de Amplatzer é frequentemente utilizada. As complicações não são comuns; a principal dela é a embolização da prótese, que era mais frequente no início da aplicação da técnica. Outras complicações são hemólise decorrente da alta velocidade quando há shunt residual, trombose femoral relacionada com a cateterização e infecção².
Figura 8. Radiografias pós-oclusão percutânea do canal arterial.
Fonte: https://radiopaedia.org/cases/transcatheter-closure-of-patent-ductus-arteriosus?lang=us
Quanto ao tratamento cirúrgico, podemos dividir as técnicas em intrapleurais e extrapleurais, estas utilizadas preferencialmente em neonatos e crianças pequenas. As técnicas extrapleurais, mais utilizadas em neonatos e lactentes, podem ser efetuadas em razão de a pleura dessas crianças apresentar maior resistência ao manuseio, permitindo sua dissecção romba, com afastamento do gradil costal oferecendo um trajeto que leva diretamente à aorta em sua porção conectada ao canal arterial, que pode ser dissecado do mesmo modo que a pleura². Deve-se estar atento ao nervo laríngeo recorrente, ramo do vago responsável pela inervação dos músculos da fonação. Possui íntima relação com o canal arterial. Lesões inadvertidas no nervo laríngeo recorrente podem ocorrer em até 4% dos pacientes, sendo de fundamental importância a visualização e proteção dessa estrutura²¹.
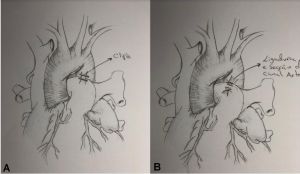
Figura 9. Opções para fechamento cirúrgico do canal arterial. (A) Clipagem. (B) Ligadura e secção.
Fonte: cortesia do Dr. Mansuor Chaer Alameddin para esta publicação.
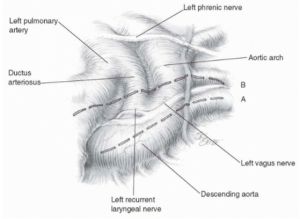
Figura 10. Anatomia cirúrgica da oclusão do canal arterial com via de acesso por toracotomia lateral esquerda.
Fonte: Ardehali e Chen²².
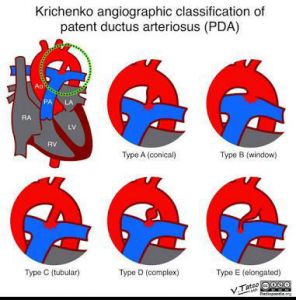
Figura 11. Classificação angiográfica de Krichenko, usada para melhor definir a opção terapêutica.
Diversos autores relatam recorrência do canal arterial pós-cirurgia, principalmente nos casos em que foi realizada a ligadura no canal arterial. Essa ocorrência, mais frequente no passado, é próxima de zero quando a secção e a sutura ou ligadura são realizadas com a técnica correta².
Geralmente os resultados cirúrgicos da oclusão do canal arterial são muito positivos. A cirurgia tem caráter curativo e o coração da criança segue em fisiologia normal quando o procedimento é realizado antes da instalação da hipertensão pulmonar. Quando já há algum grau de hipertensão pulmonar, a evolução é variável de acordo com o grau de hipertensão, podendo manter alguma limitação aos esforços e hipodesenvolvimento físico.
Referências
- Rudolph AM. The changes in the circulation after birth. Their importance in congenital heart disease. Circulation. 1970;41(2):343.
- Silva LPRG, Bembom MC, Silva MFAG, Silva PAG. Persistência do canal arterial. In: Croti UA, Mattos SS, Pinto Jr. VC, Aiello VD, Moreira VM. Cardiologia e cirurgia cardiovascular pediátrica. 2ª ed. São Paulo: Roca; 2012. p.661-672.
- Allen HD, Driscoll DJ, Shaddy RE, Feltes T. Moss & Adams’ heart disease: in infants, children, and adolescents: including the fetus and young adult. 7th ed. Philadelphia: Lippincott Williams & Wilkins; 2008.
- Smith GC. The pharmacology of the ductus arteriosus. Pharmacol Rev. 1998;50(1):35.
- Coggins KG, Latour A, Nguyen MS, Audoly L, Coffman TM, Koller BH. Metabolism of PGE2 by prostaglandin dehydrogenase is essential for remodeling the ductus arteriosus. Nat Med. 2002;8(2):91.
- Iwashima S, Satake E, Uchiyama H, Seki K, Ishikawa T. Closure time of ductus arteriosus after birth based on survival analysis. Early Hum Dev. 2018;121:37. Epub 2018 May 10.
- Gittenberger-de Groot AC, Strengers JL, Mentink M, Poelmann RE, Patterson DF. Histologic studies on normal and persistent ductus arteriosus in the dog. J Am Coll Cardiol. 1985;6(2):394.
- Bökenkamp R, Raz V, Venema A, DeRuiter MC, van Munsteren C, Olive M, et al. Differential temporal and spatial progerin expression during closure of the ductus arteriosus in neonates. PLoS ONE. 2001;6(9):e23975. doi: 10.1371/journal.pone.0023975
- Hoffman JI, Kaplan S. The incidence of congenital heart disease. J Am Coll Cardiol. 2002;39(12):1890.
- Reller MD, Strickland MJ, Riehle-Colarusso T, Mahle WT, Correa A. Prevalence of congenital heart defects in metropolitan Atlanta, 1998-2005. J Pediatr. 2008;153(6):807. Epub 2008 Jul 26.
- Gentile R, Stevenson G, Dooley T, Franklin D, Kawabori I, Pearlman A. Pulsed Doppler echocardiographic determination of time of ductal closure in normal newborn infants. J Pediatr. 1981;98(3):443.
- Koch J, Hensley G, Roy L, Brown S, Ramaciotti C, Rosenfeld CR .Prevalence of spontaneous closure of the ductus arteriosus in neonates at a birth weight of 1000 grams or less. Pediatrics. 2006;117(4):1113.
- Weiss H, Cooper B, Brook M, Schlueter M, Clyman R. Factors determining reopening of the ductus arteriosus after successful clinical closure with indomethacin. J Pediatr. 1995;127(3):466.
- Nora JJ. Multifactorial inheritance hypothesis for the etiology of congenital heart diseases. The genetic-environmental interaction. Circulation. 1968;38(3):604-617. doi: 10.1161/01.cir.38.3.604
- Libby P, Bonow RO, Mann DL, Zipes DP, editors. Webb GD, Smallhorn FJ, Terrien J, Redington AN. Congenital heart disease. In: Braunwalds’ Heart Disease. 8th ed. Philadelphia: Saunders/Elsevier; 2008. p.1561.
- Goitein O, Fuhrman CR, Lacomis JM. Incidental finding on MDCT of patent ductus arteriosus: use of CT and MRI to assess clinical importance. AJR Am J Roentgenol. 2005;184(6):1924.
- Campbell M. Natural history of persistent ductus arteriosus. Br Heart J. 1968;30(1):4.
- Thilén U, Aström-Olsson K. Does the risk of infective endarteritis justify routine patent ductus arteriosus closure? Eur Heart J. 1997;18(3):503.
- Gross RE, Hubbad JP. ¾ Surgical ligation of a patent ductus arteriosus: report of first successful case. JAMA. 1939;112:729-731.
- Baumgartner H, Bonhoeffer P, De Groot NMS, de Haan F, Deanfield JE, Galie N, et al. Eur Heart J. 2010;31:2915-2957. doi: 10.1093/eurheartj/ehq249
- Wanderley LC. Dicas práticas sobre a cirurgia de correção da persistência do canal arterial. 2020. Cardiosurgery Post [Internet]. Disponível em: https://www.cardiosurgerypost.com/single-post/dicas-praticas-sobre-a-cirurgia-de-correcao-da-persistencia-do-canal-arterial
- Ardehali A, Chen JM. Khonsari’s Cardiac Surgery. safeguards and pitfalls in operative technique. 5th ed. Philadelphia: Wolters Kluwer; 2017.