Em 14 de fevereiro de 2009, Daniela Busch, mãe de Ana Luiza, então criança portadora de cardiopatia congênita cirurgicamente corrigida com êxito, sugeriu na comunidade “Cardiopatia Congênita”, da rede social Orkut, a instituição de uma data para homenagear e compartilhar ações para viabilizar o tratamento de crianças com cardiopatias congênitas1. Em diversos países do hemisfério norte já existe uma data para tal homenagem, a exemplo dos Estados Unidos, que a comemora no dia 14 de fevereiro, concomitantemente ao Valentine’s Day (dia dos namorados). Assim, no Brasil, com o apoio das mães integrantes da comunidade virtual e da Associação de Apoio a Crianças Cardiopatas Pequenos Corações, foi aprovado um projeto de lei e desde 2012 o Dia da Conscientização da Cardiopatia Congênita é comemorado no dia 12 de junho (concomitantemente ao dia dos namorados no Brasil)1. As cardiopatias congênitas correspondem a um grupo de doenças resultantes de uma ou mais anormalidades da estrutura cardíaca presentes ao nascimento.
A incidência de cardiopatias congênitas é de 1 a cada 100 nascimentos, sendo a tetralogia de Fallot a forma cianótica mais comum dentre as cardiopatias congênitas e uma das primeiras a ser corrigida com sucesso pelos cirurgiões cardiopediátricos2. Acomete aproximadamente 3,5% das crianças com cardiopatia congênita e corresponde a 1 caso a cada 3.600 ou 0,28 a cada 1.000 nascidos vivos, com prevalência similar entre os gêneros2. A tetralogia de Fallot foi descrita inicialmente em 1671 por Niels Stenson, contudo as descrições anatômicas mais alinhadas foram ilustradas por William Hunter em 1784, no St George’s Hospital Medical School, em Londres, valendo-se do relato “a passagem do ventrículo direito para a artéria pulmonar, que deveria permitir um dedo, não era tão ampla quanto uma pena de ganso; e havia um buraco na divisão entre os dois ventrículos, larga o suficiente para a passagem de um polegar de um (lado) ao outro. A maior parte do sangue no ventrículo direito foi conduzida com o ventrículo esquerdo para a aorta, ou grande artéria, e assim perdeu toda a vantagem que deveria ter da respiração”2. Sua descrição de um amplo defeito septal na via de saída concomitante à estenose subpulmonar e da valva pulmonar, bem como sua fisiologia resultante, foi refinada por Etienne-Louis Fallot em 1888 em sua descrição L’anatomie pathologique de la maladie bleu; entretanto, o termo tetralogia de Fallot – tétrade constituída de defeito do septo ventricular, cavalgamento da aorta, obstrução da via de saída do ventrículo direito e hipertrofia ventricular direita (Figura 1) – é atribuído à médica canadense Maude Abbott, que o definiu em 19242.
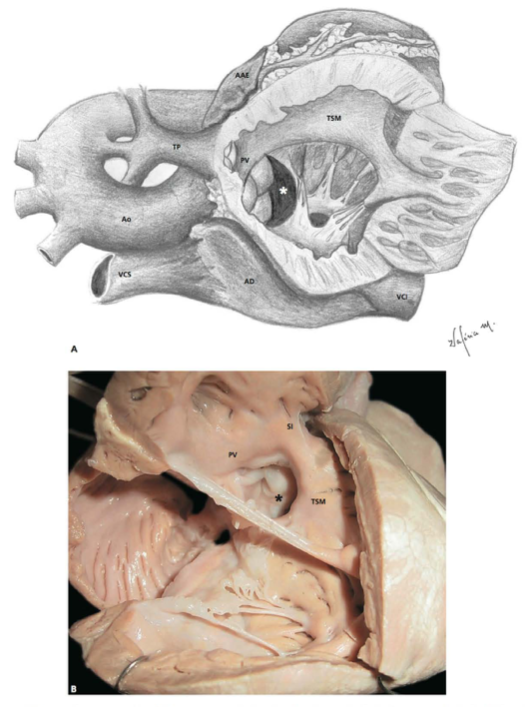
Figura 1 – (A) Ilustração demonstrando os defeitos combinados da tetralogia de Fallot. (B) Espécime de tetralogia de Fallot. AAE: apêndice atrial esquerdo; AD: átrio direito; Ao: aorta ascendente; PV: prega ventriculoinfundibular; SI: septo infundibular; TP: tronco da artéria pulmonar; TSM: trabécula septomarginal; VCI: veia cava inferior; VCS: veia cava superior. * Comunicação interventricular.
Fonte: Croti3.
Sua causa exata ainda é incerta, assim como em outras cardiopatias congênitas, parecendo ser esporádica na maioria dos casos, apesar de o risco de recorrência entre irmãos ser de 3% se não houver outros parentes de primeiro grau afetados2. Todavia, um substrato genético forte e cada vez mais reconhecido para a tetralogia de Fallot é a microdeleção da região q11 do cromossomo 22, presente em mais de 25% dos pacientes acometidos, além de a tetralogia ser frequentemente diagnosticada em pacientes com síndrome de Di George, na qual a prevalência de tal deleção é estimada em 6%, o que denota a importância do reconhecimento da deleção por sua associação não somente sistêmica e cardíaca, mas também com desordens neuropsiquiátricas tardias2.
A tetralogia de Fallot é caracterizada pelos quatro achados citados anteriormente e o marco anatômico que define a falha é o desvio anterior do septo infundibular (que, juntamente com a prega ventriculoinfundibular, formaria a crista supraventricular), em relação ao septo interventricular, culminando no estreitamento da via de saída do ventrículo direito na comunicação interventricular por mau alinhamento e na dextroposição da aorta, além da hipertrofia das trabéculas septoparietais situadas no infundíbulo subpulmonar3. A hipertrofia do ventrículo direito é justificada pelo aumento da contratilidade que se torna necessária para sobrepujar a resistência imposta pela estenose da via de saída do ventrículo direito e, assim, direcionar o sangue até o ventrículo esquerdo (shunt direita-esquerda) para atingir a raiz da aorta.
Estando clara a complexidade da condição, o tratamento inicialmente proposto foi retratado no filme Quase Deuses, de 2004, demonstrando seus detalhes até o advento da cirurgia de Blalock-Taussig (ou Blalock-Taussig-Thomas em homenagem à Vivien Thomas por sua inegável e fundamental contribuição) em 1945, mudando o prognóstico dos “bebês azuis”, como eram apelidados em decorrência da cianose. A cirurgia se vale de uma anastomose término-lateral entre a artéria subclávia direita e artéria pulmonar direita, com a finalidade de aumentar o fluxo sanguíneo pulmonar e, assim, enviar mais sangue oxigenado para o átrio esquerdo através das veias pulmonares, então para o ventrículo esquerdo e assim ganhar a circulação sistêmica após atravessar a valva aórtica (Figura 2A)3. Vale ressaltar que a técnica foi desenvolvida em uma época em que não havia auxílio da circulação extracorpórea. Já em 1962, Klinner foi pioneiro ao interpor um enxerto sintético entre as artérias subclávia e tronco pulmonar, denominada Blalock-Taussig modificada (Figuras 2B e 3), valendo-se da vantagem de preservar a circulação distal da artéria subclávia3.
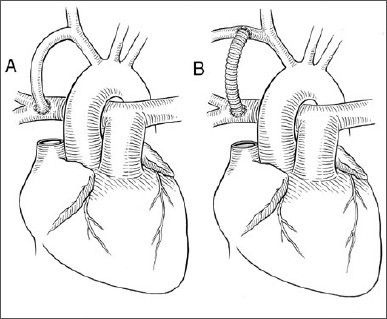 Figura 2 – (A) Cirurgia de Blalock-Taussig-Thomas. (B) Cirurgia de Blalock-Taussig modificada.
Figura 2 – (A) Cirurgia de Blalock-Taussig-Thomas. (B) Cirurgia de Blalock-Taussig modificada.
Fonte: Google Images.
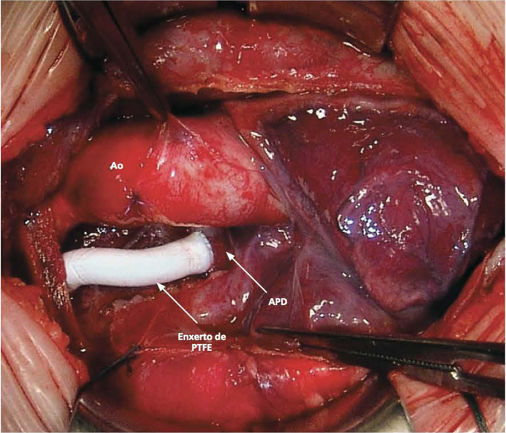
Figura 3 – Cirurgia de Blalock-Taussig modificada com tubo de politetrafluoretileno (PTFE) desde a artéria subclávia direita até o tronco da artéria pulmonar.
Fonte: Croti3.
Notadamente, as duas abordagens anteriormente citadas não são nada mais que métodos paliativos, havendo necessidade de tratamento corretivo pelo fechamento da comunicação interventricular e reparação da obstrução da via de saída do ventrículo direito ao extinguir as estenoses infundibular e anulovalvar pulmonar, além da ampliação do tronco da artéria pulmonar3. Portanto, há duas abordagens cirúrgicas para o tratamento da tetralogia de Fallot: atrial direita e ventricular direita. A abordagem atrial direita (Figura 4) pode ser realizada a fim de evitar incisão no miocárdio do ventrículo direito, sendo desafiadora pelo difícil manejo em expor os feixes musculares que obstruem a via de saída do ventrículo direito e tem início com incisão atrial direita paralela ao sulco atrioventricular, retraindo a valva tricúspide, expondo os elementos defeituosos abaixo da valva4. Logo inferiormente à valva, está a comunicação interventricular e, anteromedialmente à comunicação, está a abertura estenótica da via de saída do ventrículo direito, que é circundada por extensões musculares septais e parietais a serem divididas e ressecadas para aliviar a via de saída do ventrículo direito e, por fim, a comunicação interventricular é fechada com sutura contínua de patch protético4.
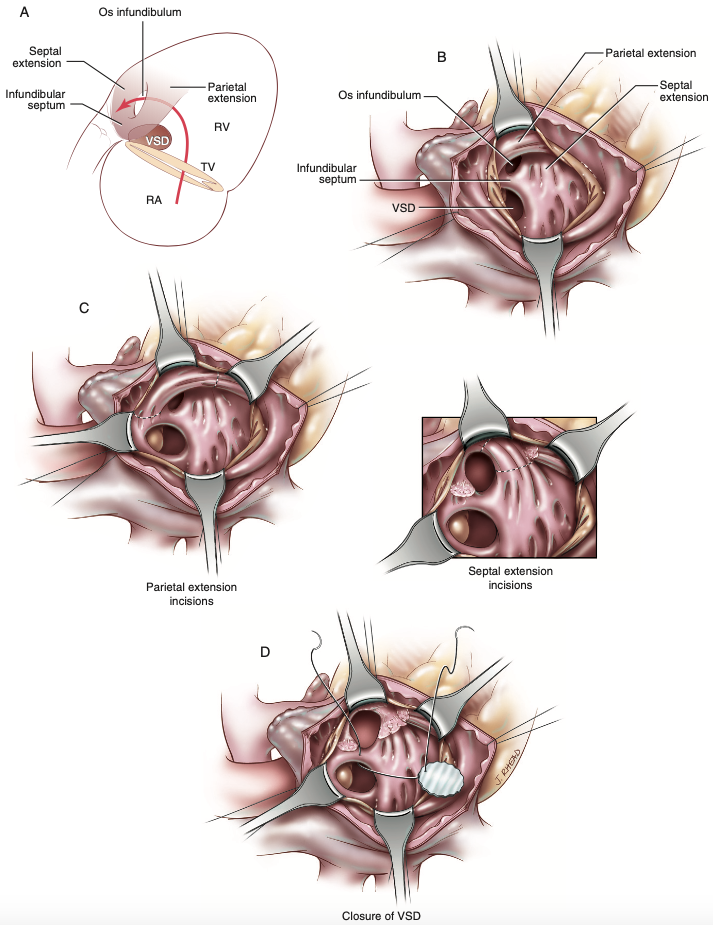
Figura 4 – (A) A seta demonstra o caminho percorrido desde a valva tricúspide até o estreitamento da via de saída do ventrículo direito. (B) Cavidade ventricular demonstrando o estreitamento da via de saída do ventrículo direito e comunicação interventricular, sendo possíveis após afastamento das cúspides da valva tricúspide. (C) Incisão dos feixes musculares. (D) Fechamento da comunicação interventricular com patch.
Fonte: Doty4.
Enquanto isso, na abordagem ventricular direita (Figura 5A-N), a incisão oferece melhor visualização dos defeitos, podendo ser feita uma única incisão através de todos os níveis de obstrução, ou incisões seletivas no ventrículo direito e no tronco da artéria pulmonar4. A incisão vertical para ventriculotomia (Figura 5A-B) é a mais utilizada na tetralogia de Fallot quando a adequação do diâmetro da artéria pulmonar ou sua região proximal é questionável, sendo feita na porção média da via de saída do ventrículo direito e as artérias coronárias são preservadas, principalmente a artéria interventricular anterior, que pode ter origem anômala4. A incisão é continuada ao anel da valva pulmonar, que é preservado se seu diâmetro for comparável ao normal com base no tamanho do paciente utilizando o dilatador de calibração Hegar, realizando valvotomia pulmonar com exposição alcançada por baixo através da incisão nas comissuras da valva4. Além disso, os feixes musculares hipertrofiados são mobilizados e excisados para nivelar com o septo interventricular4.
A incisão transversal (Figura 5C) é uma opção a ser empregada quando a anatomia superficial e as imagens pré-operatórias apontarem que o anel e a valva pulmonar possuem diâmetro adequado e a preservação é possível, sendo a vantagem desta abordagem a conservação do suprimento sanguíneo coronariano para o ventrículo direito, havendo vantagem na hemodinâmica final4. Prossegue-se com a inspeção da valva pulmonar utilizando pinça vascular para everter os folhetos da valva pulmonar à procura de fusões comissurais, sendo as comissuras visualizadas graças à pinça vascular e a incisão precisamente feita na parede da artéria pulmonar, seguindo com alargamento adicional da via de saída do ventrículo direito utilizando pinça hemostática4.
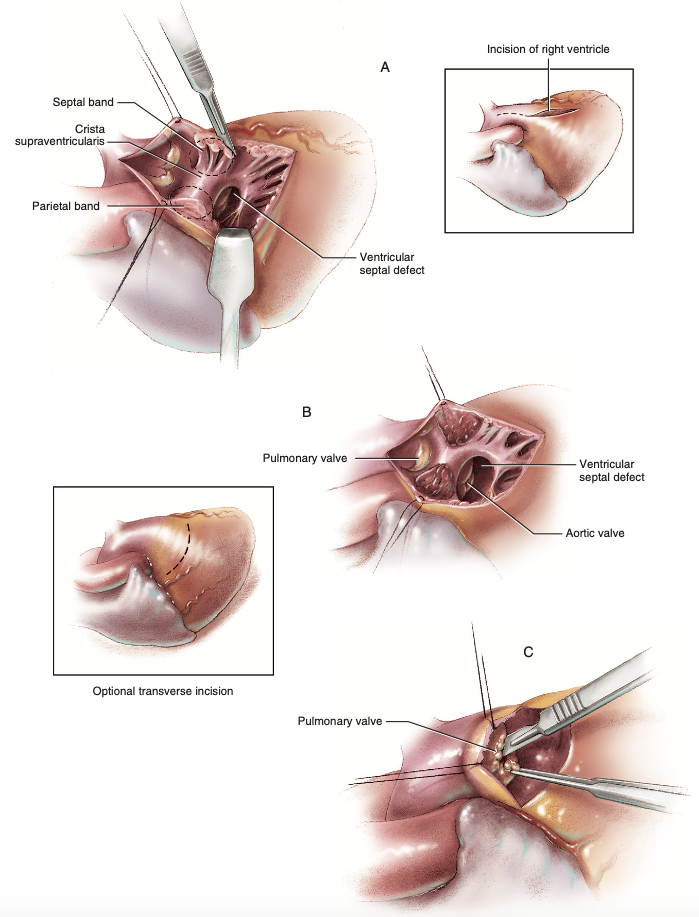
Figura 5 – (A) Ventriculotomia vertical. (B) Ressecção dos feixes hipertrofiados. (C) Incisão transversa e ampliação da via de saída do ventrículo direito.
Fonte: Doty4.
O folheto septal da valva tricúspide recobre o defeito septal e requer retração com fórceps para melhor exposição da borda póstero-inferior da comunicação interventricular, seguindo com seu fechamento por sutura com fio agulhado em suas duas pontas de polipropileno 4-0, entrando no septo interventricular 5 a 7 mm caudal à borda inferior da comunicação e saindo de 3 a 5 mm caudal à borda anterior, adjacente à cúspide septal da valva tricúspide. A outra agulha é passada através da cúspide septal próxima ao local de saída da primeira sutura, do ventrículo ao átrio e de volta pela base do folheto até o lado ventricular e assim é fechada a fenda potencial na junção entre a cúspide e o septo ventricular, enquanto se evita a área do feixe de His e todas as agulhas são passadas por baixo das cordas tendíneas (Figura 5D)4. Com a agulha passada no primeiro ponto, outros três ou quatro são colocados a uma profundidade de aproximadamente metade do septo ventricular, devendo penetrar a agulha abaixo do defeito septal e sair de 3 a 5 mm inferior à sua borda para preservar o sistema de condução (Figura 5E)4. Após atravessar a base do músculo papilar do cone (vale ressaltar que os ramos do feixe de His se espalham no septo posterior à base desse músculo), os pontos são gradualmente levados até próximo à borda do defeito septal e a parte inicial do fio de sutura é completada na crista supraventricular (Figura 5F)4. A superfície ventricular da cúspide septal é visualizada por tração e os pontos são passados na base da cúspide, ligeiramente afastados do anel valvar para evitar a passagem de pontos no corpo fibroso central, por onde passa o feixe de His e, dessa maneira, o sistema de condução é preservado e pontos horizontais contínuos são realizados passando a agulha da superfície ventricular até a atrial e então de volta à superfície ventricular até o ponto de junção da cúspide septal com o ânulo valvar aórtico, invertendo a direção da agulha e penetrando na continuidade fibrosa entre as valvas tricúspide e aórtica, saindo profundamente na musculatura ventricular (Figura 5G)4. A linha da sutura passa ao longo da musculatura ventricular com passagens substanciais na crista supraventricular, enquanto toda corda tendínea pendente é protegida e o reparo é completado após juntar os dois fios de sutura (Figura 5H)4.
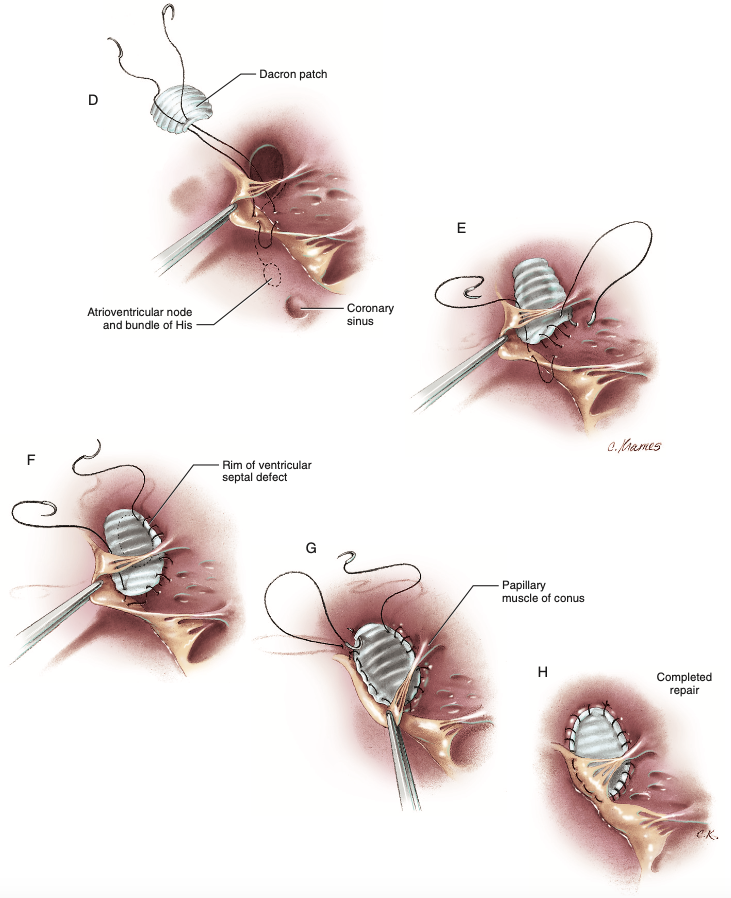
Figura 5 – (D-H) Fechamento da comunicação interventricular e passagem do fio através da cúspide septal da valva tricúspide, musculatura septal e continuação fibrosa entre as valvas tricúspide e aórtica com o patch.
Fonte: Doty4.
Quando a incisão for estendida através do anel pulmonar, a arteriotomia pulmonar e a ventriculotomia são cerradas utilizando patch protético, sendo suturado com fio polipropileno 4-0, realizando quatro passagens de fio no entorno do ápice da arteriotomia pulmonar com o patch antes de aproximá-los para que o fechamento da linha de sutura seja assegurado (Figura 5I)4. As linhas de sutura são puxadas firmemente, seguindo até o ânulo da valva pulmonar em ambos os lados, sendo as suturas ligeiramente mais largas no patch que na artéria pulmonar para que um comprimento suficiente do enxerto esteja disponível na via de saída do ventrículo direito e torne possível um abaulamento anterior para a área transversal máxima quando a via de saída estiver repleta de sangue (Figura 5J)4. Podem ser usados pontos reforçados com Teflon acolchoado (pledgets) para aproximar o enxerto à ventriculotomia e assim obter força máxima de fechamento do miocárdio (Figura 5K)4. Nos casos em que a hipoplasia acomete os ramos direito e esquerdo da artéria pulmonar além da bifurcação, é feita incisão para alargar a saída (Figura 5L) e o patch é utilizado para a reconstrução da artéria, com extensões para cobrir as incisões dos ramos pulmonares e pequena cunha é retirada na extremidade distal a fim de acomodar a bifurcação, o que evita flambagem do enxerto e consequente obstrução residual4. Em seguida são realizados cinco pontos no entorno das extensões do enxerto e do ápice da incisão em ambos ramos pulmonares antes de puxar o enxerto em direção à arteriotomia pulmonar, sendo mantida a integridade das extremidades distais da linha de sutura e os ramos pulmonares são reconstruídos e ampliados com exatidão, podendo ser necessário operar posterior e à direita da aorta ascendente caso a hipoplasia da artéria pulmonar direita siga por uma distância considerável adiante da bifurcação e as suturas e enxertos devem ser passados posteriormente à aorta para completar o segmento central do reparo e, dessa forma, as suturas antes separadas em cada ramo da artéria pulmonar são unidas na bifurcação com nó manual (Figura 5M)4. A sutura é, então, contínua ao longo das bordas direita e esquerda da arteriotomia pulmonar até o anel da valva pulmonar e completada ao redor da ventriculotomia (Figura 5N)4.
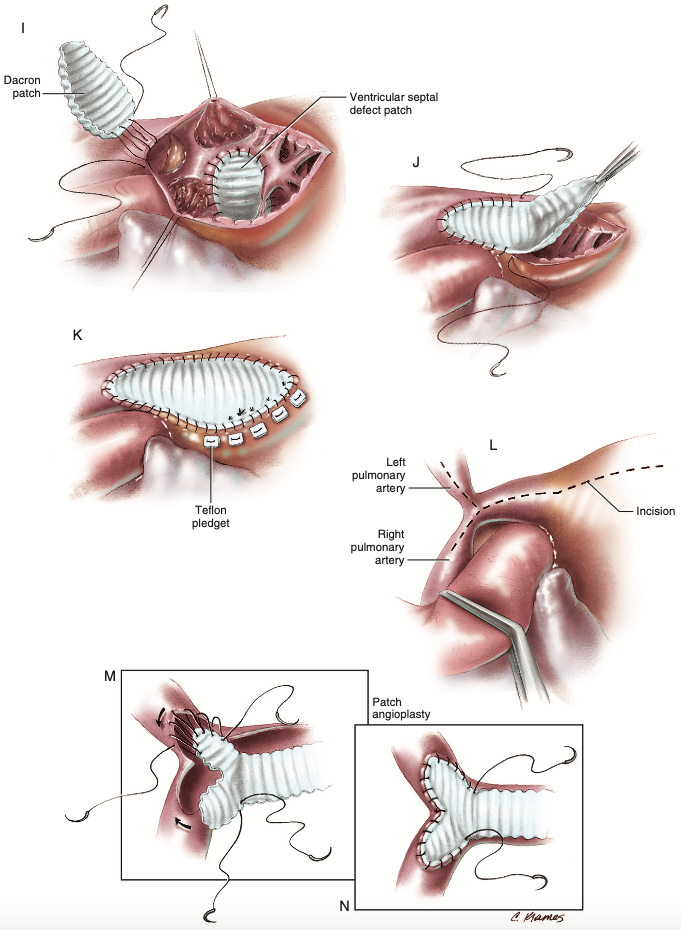
Figura 5 – (I-N) Fechamento da arteriotomia pulmonar e da ventriculotomia com patch em diferentes formas e situações.
Fonte: Doty4.
Ademais, torna-se claro o avanço no tratamento da tetralogia de Fallot com o advento de novas tecnologias como a circulação extracorpórea, que, aliada ao refinamento cirúrgico, promoveu o tratamento definitivo e não mais somente o paliativo dessa condição severa presente em nosso meio, sendo provavelmente a cardiopatia congênita mais emblemática.
Referências
- Estado de Minas. 12 de junho: Dia da conscientização da cardiopatia congênita. [acesso em: 2020 jun. 09]. Disponível em: https://www.em.com.br/app/noticia/patrocinado/biocor/2018/06/04/patrocinado–biocor,964359/12-de-junho-dia-da-conscientizacao-da-cardiopatia-congenita.shtml
- Apitz C, Webb GD, Redington AN. Tetralogy of Fallot. Lancet. 2009;374:1462-71.
- Croti UA, Mattos SS, Pinto Jr VC, Aiello VD, Moreira VM. Cardiologia e cirurgia cardiovascular pediátrica. 2. ed. São Paulo: Roca; 2013.
- Doty D, Doty J. Cardiac surgery operative technique. 2. ed. Philadelphia: Saunders; 2012.