
O coração é comumente acessado via esternotomia mediana. É possível que muitas dessas crianças cujo transplante é a terapia indicada já tenham sido submetidas a reparos anteriores ou ao implante de um dispositivo de assistência circulatória, o que implica uma reesternotomia. A serra é cuidadosamente utilizada para abrir primeiro a tábua esternal anterior e, em seguida, a posterior. Aderências são cautelosamente liberadas da parede torácica para, após abrir o pericárdio previamente fechado, finalmente acessar o coração. A aorta é exposta e uma cânula arterial é introduzida para o retorno do sangue oxigenado pela máquina de circulação extracorpórea. As veias cavas, superior e inferior, também são canuladas para drenar o sangue venoso em direção à máquina, e é iniciada a circulação extracorpórea. Em uma coreografia muito bem conectada e sintonizada com o contato com a equipe de captação do órgão, é feito o clampeamento da aorta ascendente o mais distal possível e a cardiectomia é iniciada.
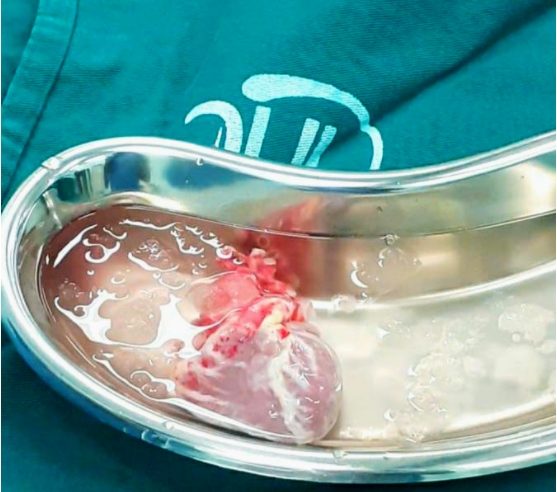
Figura 1. Coração de um doador de 1 ano e 3 meses aguardando na mesa auxiliar para implante em um receptor de 10 meses, portador de hipoplasia do coração esquerdo com falência da circulação univentricular após cirurgia de Norwood-Glenn.
Fonte: imagem de Gabriel R Bittencourt.
Nesse momento, a equipe de captação já levou o órgão do doador até a sala operatória e nela o coração, que já fora inspecionado dinâmica e estaticamente no momento da captação, é novamente inspecionado. O cirurgião busca quaisquer anomalias estruturais; o forame oval, presente em 20 a 25% dos casos, é fechado e o coração é preparado para o implante no receptor, que neste momento participa de um momento encantador de simbiose entre ser humano e máquina: no tórax não há coração, apenas as estruturas remanescentes do receptor que serão anastomosadas às estruturas do doador. A vida é mantida pela máquina de circulação extracorpórea, por onde a vida flui entre tubos, conexões, roletes e membranas, orquestrada brilhantemente pelo perfusionista. Já no mediastino médio do receptor, o implante do coração é iniciado pelo crucial alinhamento do átrio esquerdo com sua posterior anastomose com o remanescente atrial esquerdo do receptor. Garantindo esse crítico alinhamento das estruturas atriais esquerdas do doador e do receptor, a aorta e a artéria pulmonar estão agora alinhadas com suas respectivas estruturas receptoras e são anastomosadas. O ar do sistema esquerdo é retirado, a aorta é desclampeada e o novo coração, em sua nova casa, começa a acordar do sono induzido pela solução cardioplégica, que o adormeceu e protegeu enquanto o trajeto entre as duas vidas era feito. O coração se espreguiça enquanto o sangue flui desde os óstios coronarianos até o retorno ao átrio direito pelas veias cardíacas, as fibras nervosas vão paulatinamente se organizando, o impulso nervoso se orienta. Ao monitor multiparamétrico, as ondas de pulso na linha arterial e os complexos QRS na cardioscopia anunciam: o coração acordou para que a nova vida flua por ele, batimento a batimento. Os sorrisos escondidos por trás das máscaras são facilmente vistos nos olhos da equipe, mas o trabalho ainda não acabou. Após a anastomose das veias cavas superior e inferior, uma cuidadosa hemostasia é feita e, após confirmar os parâmetros hemodinâmicos satisfatórios, o paciente é retirado de circulação extracorpórea e o transplante está concluído.
O supracitado é apenas um breve resumo de um caso de um procedimento encantador e instigante que, como tudo no campo da cirurgia cardiovascular, é recheado de história, ciência, legados e arte. Sobretudo no que tange ao transplante cardíaco pediátrico, pois é nos pequenos corações que essa história ganha ainda mais detalhes, minúcias e particularidades muito interessantes.
Na madrugada do dia 6 de dezembro de 1967, apenas três dias após o Dr. Christiaan Barnard ter realizado com sucesso na África do Sul o primeiro transplante cardíaco do mundo, o Dr. Adrian Kantrowitz foi responsável pela primeira tentativa de transplante cardíaco pediátrico, no qual o coração fora explantado de um doador anencefálico e implantado em um bebê com 19 dias de vida, portador de anomalia de Ebstein, em estado de insuficiência cardíaca. O receptor sobreviveu por apenas pouco mais de 6 horas e o próprio Dr. Kantrowitz afirmou em entrevista que não considerou a cirurgia um sucesso.
 Figura 2. Dr. Christiaan Barnard, Dr. Michael DeBakey e Dr. Adrian Kantrowitz em 24/12/1967.
Figura 2. Dr. Christiaan Barnard, Dr. Michael DeBakey e Dr. Adrian Kantrowitz em 24/12/1967.
Fonte: disponível em: https://whyy.org/articles/50-years-heart-transplant-surgery-hasnt-changed-significantly/
Em 26 de outubro de 1984, o Dr. Leonard Bailey, da Universidade de Loma Linda, fez o primeiro xenotransplante pediátrico, substituindo o debilitado coração de uma bebê de 16 dias de vida pelo coração de um babuíno. Esse transplante interespécies gerou grande controvérsia, trazendo bastante revolta na imprensa, no meio médico e nas entidades protetoras dos animais. Baby Fae, como a paciente ficou conhecida, sobreviveu por 21 dias e faleceu em decorrência de um processo de rejeição do órgão. Mesmo com toda a controvérsia gerada, o acontecimento foi motivador da organização de um serviço muito forte de transplante cardíaco pediátrico na Universidade de Loma Linda. Em 1985, o próprio Dr. Bailey realizou o primeiro transplante neonatal com sucesso.
 Figura 3. Dr. Leonard Bailey, 1987.
Figura 3. Dr. Leonard Bailey, 1987.
Fonte: disponível em https://www.nytimes.com/2019/05/22/obituaries/dr-leonard-bailey-dead.html
O primeiro transplante cardíaco pediátrico do Brasil foi liderado pelo Dr. Miguel Barbero-Marcial, no Instituto do Coração da Faculdade de Medicina da Universidade de São Paulo. Tratava-se de um bebê de 12 dias de vida com síndrome da hipoplasia do coração esquerdo, que sobreviveu por 45 dias, falecendo em decorrência de um processo de rejeição.
A partir do incremento na modulação imunológica com o advento da ciclosporina em 1979, os transplantes, que haviam perdido força durante a década de 1970 em razão das deficiências no manejo do processo de rejeição, retornaram em franca ascensão na década de 1980, seguindo para uma relativa estabilização que contabiliza hoje cerca de 500 transplantes cardíacos pediátricos por ano no mundo.
Figura 4. Prof. Dr. Miguel Lorenzo Barbero-Marcial
Fonte: disponível em http://www.incor.usp.br/sites/cirtoracica.259-es/index.php/79-docentes
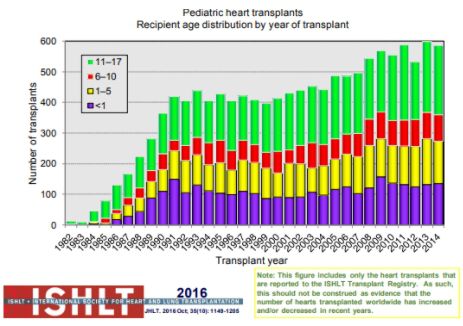 Figura 5. Número total de receptores de transplante cardíaco pediátrico por idade e ano do transplante (dados da International Society of Heart and Lung Transplantation).
Figura 5. Número total de receptores de transplante cardíaco pediátrico por idade e ano do transplante (dados da International Society of Heart and Lung Transplantation).
Fonte: Rossano et al.[1].
O diagnóstico primário das crianças submetidas aos transplantes modificou-se ao longo do tempo. Em crianças com idade inferior a 1 ano, a doença cardíaca congênita permaneceu o diagnóstico subjacente mais prevalente nas indicações de transplante, porém a proporção das cardiomiopatias como diagnóstico subjacente à insuficiência cardíaca praticamente dobrou dentro do período analisado (1988-2015).
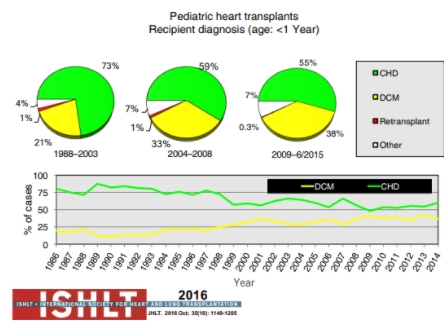 Figura 6. Diagnóstico em receptores de transplante cardíaco pediátrico com menos de 1 ano de idade (dados da International Society of Heart and Lung Transplantation). CHD: congenital heart defect (doença cardíaca congênita); DCM: dilated cardiomyopathy (cardiomiopatia dilatada).
Figura 6. Diagnóstico em receptores de transplante cardíaco pediátrico com menos de 1 ano de idade (dados da International Society of Heart and Lung Transplantation). CHD: congenital heart defect (doença cardíaca congênita); DCM: dilated cardiomyopathy (cardiomiopatia dilatada).
Em pacientes mais velhos, entretanto, as cardiomiopatias são o diagnóstico primário mais prevalente. Acompanhando de forma diretamente proporcional à idade, o número de retransplantes também aumenta.
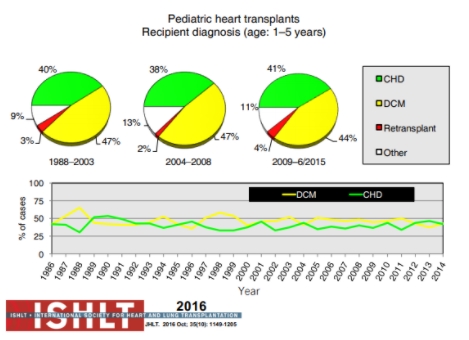 Figura 7. Diagnóstico em receptores de transplante cardíaco pediátrico de 1 a 5 anos de idade (dados da International Society of Heart and Lung Transplantation). congenital heart defect (doença cardíaca congênita); DCM: dilated cardiomyopathy (cardiomiopatia dilatada).
Figura 7. Diagnóstico em receptores de transplante cardíaco pediátrico de 1 a 5 anos de idade (dados da International Society of Heart and Lung Transplantation). congenital heart defect (doença cardíaca congênita); DCM: dilated cardiomyopathy (cardiomiopatia dilatada).
Fonte: Rossano et al.[1].
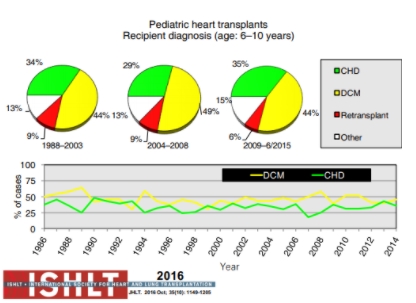
Figura 8. Diagnóstico em receptores de transplante cardíaco pediátrico com 6 a 10 anos de idade (dados da International Society of Heart and Lung Transplantation). congenital heart defect (doença cardíaca congênita); DCM: dilated cardiomyopathy (cardiomiopatia dilatada).
Fonte: Rossano et al.[1].
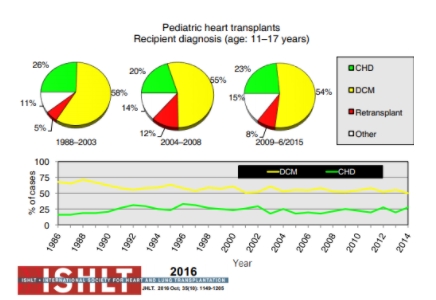
Figura 9. Diagnóstico em receptores de transplante cardíaco pediátrico com menos 11 a 17 anos de idade (dados da International Society of Heart and Lung Transplantation). congenital heart defect (doença cardíaca congênita); DCM: dilated cardiomyopathy (cardiomiopatia dilatada).
Fonte: Rossano et al.[1].
A sobrevida no transplante cardíaco pediátrico se mantém com uma relativa constância nas diferentes faixas etárias. A análise mais recente da International Society for Heart and Lung Transplantation (ISHLT) mostra uma sobrevida média de 22,3 anos para receptores com menos de 1 ano de idade, 18,4 anos para aqueles com 1 a 5 anos e 13,1 anos para aqueles com mais de 11 anos. Felizmente, esses números seguem uma tendência anual de melhora.
O diagnóstico antes do transplante também tem influência na taxa de sobrevida. A doença cardíaca congênita está associada a uma mortalidade precoce significativamente maior em comparação com a cardiomiopatia. A sobrevida geral de pacientes com cardiomiopatia em três anos após o transplante foi de 88%, em comparação com 79% para pacientes com doença cardíaca congênita. Entretanto, essa diferença é invertida ao analisar os 10 anos após o transplante, em que a sobrevida é de 70 e 68%, respectivamente.
No transplante cardíaco pediátrico há uma série de dificuldades e desafios a serem vencidos, desde a dificuldade técnica encontrada em determinados casos até os desafios logísticos.
Há uma escassez de doadores em idade pediátrica e a origem desse problema é multifatorial, podendo ser encontrada na falta de notificação, na falta de estrutura no hospital de origem, na incompatibilidade de peso e na recusa familiar. Ao lidar com crianças, o fator emocional da família está ainda mais presente. Especialmente no Brasil, um país de dimensões continentais, também há dificuldade para captação de órgãos em lugares muito distantes ou com acesso dificultado. Nesse caso, o desafio é biológico: respeitar o tempo máximo de isquemia para manter o órgão viável.
No que tange ao aspecto técnico, o transplante cardíaco pediátrico, sobretudo nas cardiopatias congênitas, pode ser bastante desafiador a depender da complexidade anatômica da criança, como crianças já submetidas a cirurgias paliativas, como as de Norwood ou Norwood-Glenn, e crianças portadoras de dextrocardia ou situs inversus, ausência de tronco pulmonar, veia cava superior esquerda persistente, isomerismos e heterotaxias, hipoplasias da aorta e estenose das artérias pulmonares.
Tais peculiaridades trazem ainda mais beleza e profundidade ao transplante cardíaco quando realizado na população pediátrica, que exige ainda mais sensibilidade do cirurgião ao lidar com anatomias complexas de órgãos pequenos, em um tórax que pertence a uma criança que ainda tem uma vida inteira pela frente.
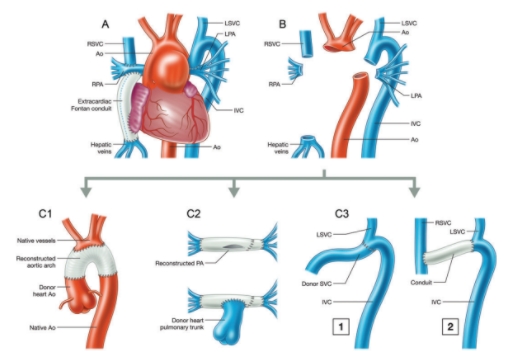
Figura 10. Exemplo de reconstrução em um paciente com anomalias de todos os grandes vasos. (A) Antes da excisão do coração do receptor. (B) Após a cardiectomia do receptor. (C1) Reconstrução do arco aórtico com enxerto protético. (C2) Reconstrução de artéria pulmonar de hilo a hilo usando tubos Gore-Tex. (C3) Anastomose da hemiázigos da veia cava inferior para a cava superior esquerda direita do doador usando a veia cava superior do doador (1) ou um conduto pericárdico (2).
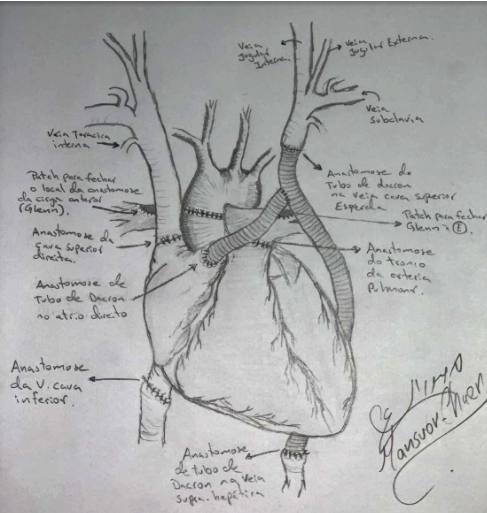 Figura 12. Exemplo de transplante em anatomia complexa. O desenho ilustra um transplante feito em uma criança de 12 anos, com veia cava superior esquerda persistente e cirurgia de Glenn prévia em ambos os ramos pulmonares. Além disso, a veia supra-hepática tinha como destino de sua drenagem o átrio direito diretamente, não a cava inferior, como habitual.
Figura 12. Exemplo de transplante em anatomia complexa. O desenho ilustra um transplante feito em uma criança de 12 anos, com veia cava superior esquerda persistente e cirurgia de Glenn prévia em ambos os ramos pulmonares. Além disso, a veia supra-hepática tinha como destino de sua drenagem o átrio direito diretamente, não a cava inferior, como habitual.
Fonte: cirurgia realizada pelo Dr. Marcello Gomide, imagem cortesia do Dr. Mansuor Chaer Alameddin.
18“O bisturi é menor, os fios de sutura não são mais grossos do que um fio de cabelo. Para operar o coração de crianças, é preciso saber manusear esses e outros instrumentos cirúrgicos adaptados às complexidades do órgão infantil, pequeno como um punho fechado. É necessário combinar delicadeza, precisão, extremo cuidado e ousadia; tomar decisões difíceis, estudar intensamente, debater com os colegas e, sobretudo, conhecer de perto a história e as condições físicas dos pequenos pacientes.”
Prof. Marcelo B. Jatene