A Oxigenação por Membrana Extra-corpóreaou Extracorporeal Membrane Oxygenation (ECMO) faz parte do que chamamos de Suporte de Vida Extracorpóreo ou Extracorporeal Life Support (ECLS). A ECMO está para o sistema cardiorrespiratório, assim como a diálise está para o sistema renal. A ECMO pode ser entendida, de maneira restrita, como um análogo à máquina de circulação extracorpórea (CEC) que é utilizada durante a cirurgia cardiovascular, mas que pode ser utilizada a longo prazo, fornecendo suporte respiratório e/ou cardíaco ao paciente.
O primeiro caso de ECMO bem-sucedido, foi publicado em 1972, no artigo “Prolonged extracorporeal oxigenation for acute post-traumatic respiratory failure (shock-lung syndrome)”. Esse relato é de um paciente jovem, politraumatizado e apresentando rotura da aorta torácica, que foi corrigida cirurgicamente. No 4º dia de pós-operatório, evoluiu com insuficiência respiratória hipoxêmica. A equipe cirúrgica responsável pelo caso indagou o uso de uma CEC a longo prazo, e decidiu pela instalação, no 6º dia de pós-operatório, da membrana de Branson: um precursor da ECMO veno-arterial, que permaneceu por 75 horas, com melhora progressiva da função pulmonar e da oxigenação do paciente. Em carta para o editorial, o médico e pesquisador WM Zapol, concluiu que a “ECMO é uma ponte para se manter a oxigenação e a perfusão tecidual, até que a doença pulmonar possa de alguma forma se resolver.” 1
O sistema da ECMO funciona da seguinte forma: através de uma cânula, o sangue venoso é drenado para o sistema, onde é impulsionado por meio de uma bomba centrífuga, ou na minoria dos casos uma bomba de rolete, para uma membrana oxigenadora. Após as trocas gasosas o sangue é re-aquecido, retornando ao paciente por meio de uma outra cânula que pode ser posicionada no leito venoso – quando é necessário fornecer suporte apenas pulmonar, ou no leito arterial – quando opta-se por fornecer suporte cardiopulmonar. 2-4
A bomba centrífuga gera rotações a partir de um sistema de gravitação eletromagnética, que gera uma pressão negativa no interior do sistema e causa menos hemólise quando comparada com o sistema de bomba de rolete que é muito comum na CEC. Já a membrana oxigenadora é composta de diversos túbulos semi-permeáveis que favorecem a hematose por meio de difusão simples, ela apresenta três funções: oxigenação, eliminação de gás carbônico e troca de calor. 2-4
Para a regulação das trocas gasosas entre a membrana e o sangue do paciente devemos regular dois parâmetros: a fração entregue de oxigênio (FdO2) e o gás de arraste (ou Sweep Gas). A FdO2 nada mais é que a porcentagem de oxigênio ofertada para o paciente e varia de 21% até 100%, muito semelhante à fração inspiratória de oxigênio (FiO2) que é regulada na ventilação mecânica. Quanto maior a fração de oxigênio ofertada para o paciente, maior é a capacidade de oxigenar seu sangue – e maior as lesões oxidativas próximas a membrana. O gás de arraste (Sweep Gas) corresponde à velocidade que o ar comprimido é injetado dentro dos túbulos, à semelhança de um fluxômetro. Quanto maior essa velocidade, maior é a capacidade de eliminação do gás carbônico. 2-4
A região entre a bomba centrífuga e a membrana oxigenadora é conhecida como zona de segurança, ou safe zone, recebe esse nome pois é uma região de pressão positiva antes do sangue ser enviado para a membrana, sendo assim um ponto do circuito segura em que há menos risco de gerarmos embolia gasosa, pois a tendencia do sangue é extravasar do circuito impedindo a entrada de ar e, portanto, ideal para o acoplamento de dispositivos, como máquinas de diálise – sim, é possível associar ambas as terapias. 2-4
Geralmente inicia-se a terapia com ECMO em suporte total e, progressivamente, desmama-se até suporte parcial, enquanto o órgão afetado recupera a sua função com ajuda do tratamento adequado administrado concomitantemente – ponte para recuperação. É importante salientar que a ECMO, usualmente, não trata a condição que causou a insuficiência cardíaca e/ou pulmonar, ela é um meio de suporte que permite um fluxo sanguíneo e as trocas gasosas adequadas por um determinado período, até que o tratamento seja estabelecido ou até que o órgão para o transplante esteja disponível – ponte para transplante. Uma pessoa pode ficar em ECMO por apenas algumas horas, usualmente por alguns dias, porém, em alguns casos, podem ser necessários semanas ou meses até que o paciente esteja apto ao desmame do suporte. A ECMO é uma tecnologia que exige um time multiprofissional na sua condução, e o perfusionista tem um papel de extrema importância neste cenário.2-4
E como funcionam as principais modalidades e quais as suas indicações?
Na canulação veno-venosa, o suporte oferecido para o paciente é apenas pulmonar. Geralmente, o sangue é drenado pela veia cava inferior ou veia femoral e devolvido na junção entre veia cava superior e átrio direito. É esperado que uma pequena porcentagem do sangue oxigenado recircule pelo dispositivo de ECMO. No entanto, a maior parte segue o fluxo fisiológico, seguindo átrio e ventrículo direitos, circulação pulmonar, átrio e ventrículo esquerdos, aorta, perfundindo, então, todos os órgãos e sistemas. Importante ressaltar que mesmo em ECMO o paciente deve fazer uso de ventilação mecânica para evitar lesão alveolar e atelectasias.2-4
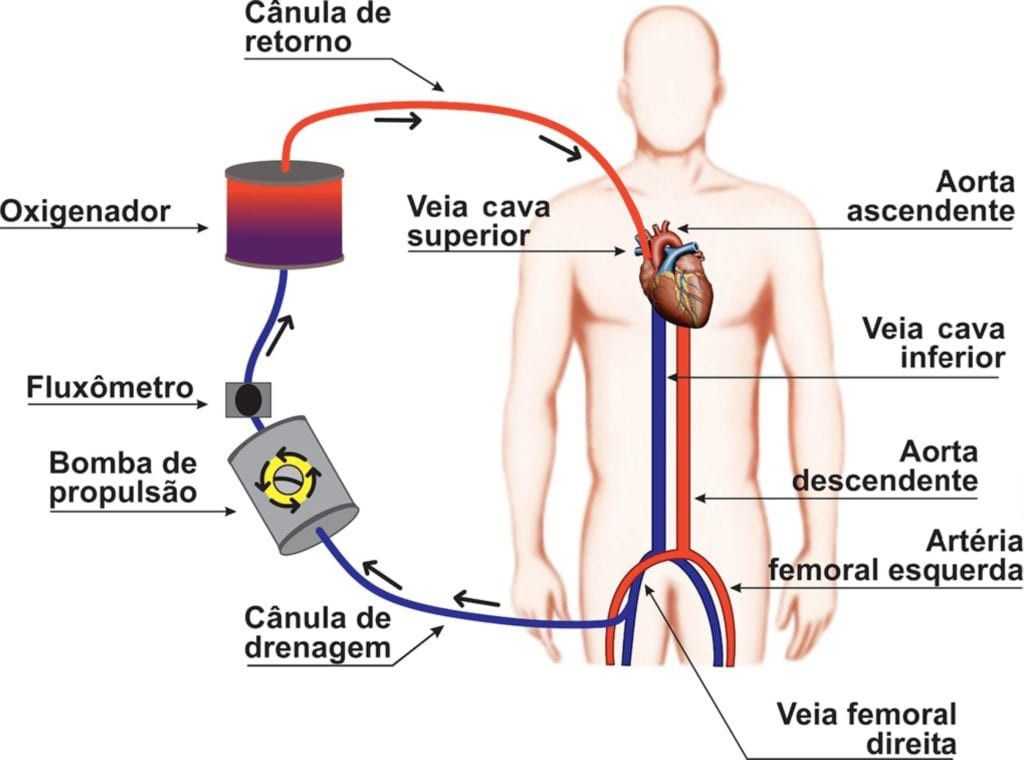
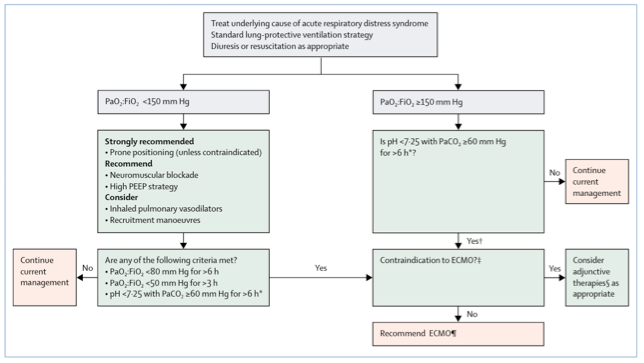
As principais indicações para a canulação veno-venosa são: síndrome de desconforto respiratório com hipoxemia refratária, pré e pós transplante pulmonar, trombo-embolismo pulmonar, asma e doença pulmonar obstrutiva crônica refratários, além disso podemos usar parâmetros clínicos como: escore de Murray (CESAR Trial ≥ 3), relação PaO2/FiO2 < 80 mmHg por mais de 6 horas, relação PaO2/FiO2 < 50 mmHg por mais de 3 horas ou pH < 7,25 com pCO2 ≥ 60 mmHg por mais de 6 horas.2-4. Essas indicações se mantém no contexto do COVID-19, conforme o último Guideline da ELSO sobre ECMO em COVID-19. 5
Na canulação veno-arterial, suporte oferecido é cardíaco e pulmonar. Do mesmo modo como citado na canulação veno-venosa, o sangue é drenado da veia cava inferior ou veia femoral. A diferença é que, ao ser devolvido para o paciente, ele retorna no leito arterial. Mais comumente, o sangue oxigenado é devolvido em uma das artérias femorais (ECMO periférica) – gerando perfusão retrograda da aorta e vasos aórticos, incluindo carótidas e sistema coronário. No contexto de pós operatório de cirurgia cardíaca (ECMO pós-cardiotomia) é mais comum a manutenção da anulação central em Aorta e Átrio Direito (ECMO central).2-4
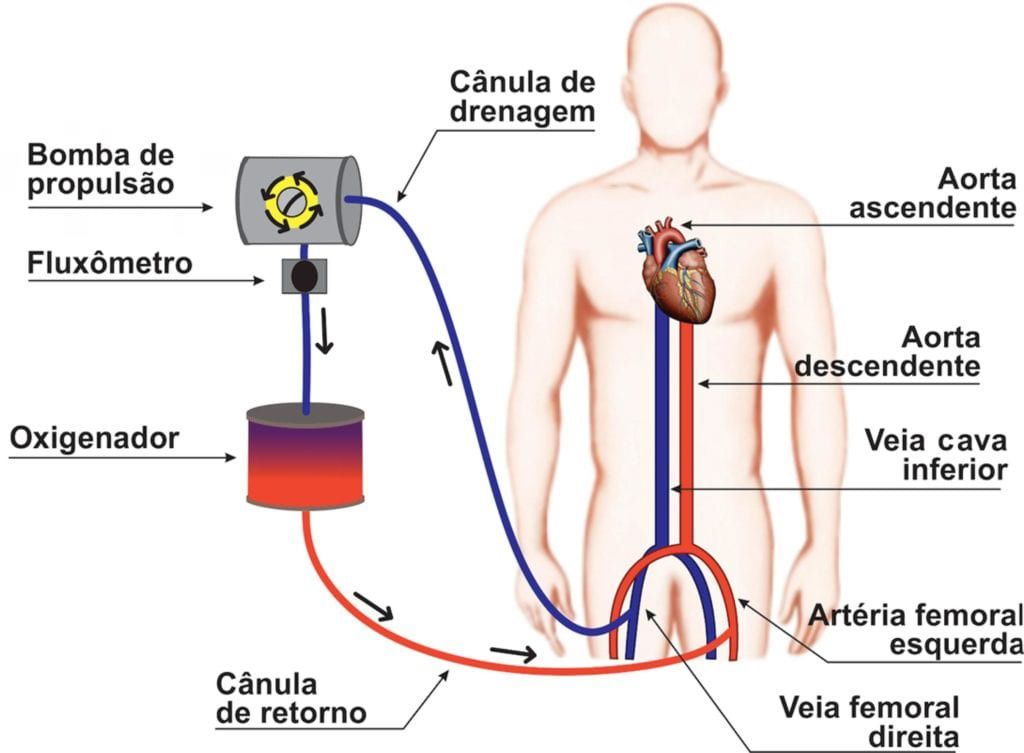
As principais indicações para a canulação veno-arterial são: pré e pós transplante cardíaco, fibrilação ventricular e taquicardia ventricular refratários, infarto miocárdico, insuficiência cardíaca, pós-cardiotomia, tromboembolismo pulmonar e choque cardiogênico com altas doses de drogas vasoativas com índice cardíaco < 2, após parada cardiorrespiratória (e-CPR). 2-4
As principais contraindicações a ECMO são: idade avançada (acima de 70 anos), pacientes com baixa expectativa de vida e muitas comorbidades, pH sanguíneo < 6,8, score de Murray <3, falência de múltiplos órgãos de origem não-cardiopulmonar, neoplasias malignas, tempo extenso em ventilação mecânica e falha na posição prona. 2-4
Alguns parâmetros da ECMO:
O
fluxo sanguíneo deve ser calculado baseado na superfície corporal do paciente, segundo a
expressão: SC x 2,4 – gerando resultado em mL/Kg/Min.
Podemos usar também valores médios a depender da faixa etária e superfície do paciente.
Para neonatos 120-150 ml/kg/min, para crianças 100-120 ml/kg/min e para adultos 70-80
ml/kg/min. 2-4
O fluxo de oxigênio no oxigenador deve ser baseado no volume sanguíneo que passa pelo sistema, dessa forma ajustamos a proporção litro de gás por litro de sangue, onde podemos expressar 1:1, 1:2, etc. A depender de quanto de CO2 queremos lavar. 2-4
A temperatura do sangue ejetado no sistema vascular deve ser próxima a temperatura de drenagem entre 36 e 37 graus Celsius. 2-4
Almejamos uma PaO2 maior que 150 mmHg, uma PCO2 entre 35 e 45 mmHg, SvO2 superior a 70%, um tempo de coagulação ativa (TCA) maior que 180 segundos, além disso a pressão pós-oxigenador na ECMO veno-venosa deve ser de 40 mmHg e na ECMO veno-arterial entre 200-300 mmHg. Para tanto devemos solicitar gasometria, TCA e hemograma desses pacientes de forma seriada. 2-4
Na ECMO veno-venosa a oxigenação depende do fluxo de sangue, demandando, assim, alto fluxo e devemos guia-la pela SVO2 e pelo lactato. Já a ECMO veno-arterial deve ser guiada pela PaO2, SvO2 e lactato. Problemas no oxigenador devem ser investigadas sempre que PaO2 menor que 130mmHg em FiO2 de 100% e/ou gradiente de pressão for superior à 100mmHg. 2-4
Por fim, é importante entender que no sistema de ECMO temos 3 pressões que devem ser sempre avaliadas: A pressão pré-bomba, que se interpõe entre a cânula venosa e a bomba centrífuga e representa a pressão de drenagem do sangue do paciente, pressão essa, que é sempre negativa. A pressão pré-membrana, que se refere à pressão exercida pelo sangue contra as paredes da cânula enquanto é empurrado pela bomba centrífuga até a membrana de oxigenação. Seu valor é sempre positivo e menor que o valor da pressão pós-membrana, que se localiza entre a membrana de oxigenação e o paciente. Podemos interpretá-lo como a dificuldade que o dispositivo tem de retornar o sangue para o paciente, quer seja no seu leito venoso, quer seja no seu leito arterial. As alterações nesses parâmetros são importantes no rastreio de complicações e defeitos no equipamento. 2-4
De forma simples podemos dizer que tudo o que aumenta a pré-carga da bomba centrífuga, facilita o fluxo sanguíneo pelo circuito de ECMO: a volemia, o tônus venoso, posição da cânula venosa, além do diâmetro da cânula venosa. De modo contrário, o que aumenta a pós-carga da bomba, dificulta o fluxo sanguíneo: resistência da membrana de oxigenação (geralmente causada por trombos), resistência vascular sistêmica (na ECMO veno-arterial), resistência vascular pulmonar (na ECMO veno-venosa), bem como a posição, diâmetro da cânula de retorno para o paciente (quanto menor o diâmetro maior a pós-carga) e comprimento do circuito (quanto maior o comprimento maior a pós-carga). 2-4
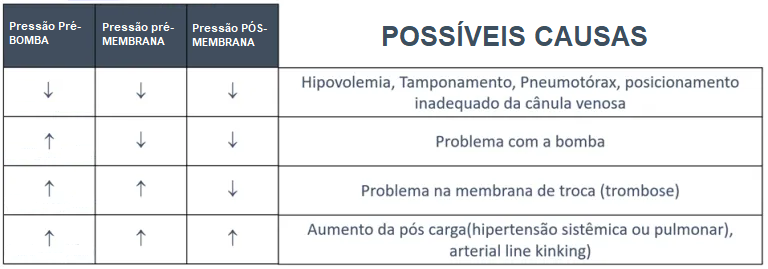
O reconhecimento topográfico de onde está o problema de fluxo, nos permite intervir etiologicamente a fim de manter o adequado funcionamento do dispositivo. Podemos, por exemplo, proceder a expansão volêmica, ajuste de velocidade de rotação da bomba, troca da membrana de oxigenação e titulação de vasopressores, a depender a situação.
Referências bibliográficas:
1. Hill JD, O’Brien TG, Murray JJ, Dontigny L, Bramson ML, Osborn JJ, Gerbode F. Prolonged extracorporeal oxygenation for acute post-traumatic respiratory failure (shock-lung syndrome). Use of the Bramson membrane lung. N Engl J Med. 1972 Mar 23;286(12):629-34. doi: 10.1056/NEJM197203232861204. PMID: 5060491.
2. Brodie D, Slutsky AS, Combes A. Extracorporeal Life Support for Adults With Respiratory Failure and Related Indications: A Review. JAMA. 2019 Aug 13;322(6):557-568. doi: 10.1001/jama.2019.9302. PMID: 31408142.
3. Richardson ASC, Tonna JE, Nanjayya V, Nixon P, Abrams DC, Raman L, Bernard S, Finney SJ, Grunau B, Youngquist ST, McKellar SH, Shinar Z, Bartos JA, Becker LB, Yannopoulos D, BˇelohlÁvek J, Lamhaut L, Pellegrino V. Extracorporeal Cardiopulmonary Resuscitation in Adults. Interim Guideline Consensus Statement From the Extracorporeal Life Support Organization. ASAIO J. 2021 Mar 1;67(3):221-228. doi: 10.1097/MAT.0000000000001344. PMID: 33627592; PMCID: PMC7984716.
4. Peek GJ, Mugford M, Tiruvoipati R, Wilson A, Allen E, Thalanany MM, Hibbert CL, Truesdale A, Clemens F, Cooper N, Firmin RK, Elbourne D; CESAR trial collaboration. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial. Lancet. 2009 Oct 17;374(9698):1351-63. doi: 10.1016/S0140-6736(09)61069-2. Epub 2009 Sep 15. Erratum in: Lancet. 2009 Oct 17;374(9698):1330. PMID: 19762075.
5. ECMO for COVID-19: Updated 2021 Guidelines from the Extracorporeal Life Support Organization (ELSO). ASAIO Journal Publish Ahead of Print. 2021. Available on: https://www.elso.org/Resources/Guidelines.aspx
18