Durante o processo que vai desde a oferta da doação de órgãos até a alta hospitalar do paciente transplantado, o pico de tensão da equipe de transplante cardíaco compreende desde o pinçamento da aorta do doador até a liberação da pinça de aorta e reperfusão do receptor. Contudo, o ápice do zelo e da atenção necessários certamente se reserva ao momento da proteção miocárdica.
A alta demanda metabólica cardíaca, associada à ausência completa de oferta de oxigênio na anóxia por tempo excessivo, pode implicar a perda irreversível de miócitos e disfunção primária do enxerto. Desse modo, nem mesmo o cirurgião mais ágil e habilidoso, com tempos cirúrgicos curtíssimos e suturas perfeitas, pode conseguir compensar o coração que não foi protegido e conservado adequadamente.
Conservação do enxerto no primeiro transplante cardíaco
Desde o primeiro transplante cardíaco, realizado em 3 de dezembro de 1967 pelo Dr. Christiaan N. Barnard, a preservação do coração doado após a cardiectomia foi uma preocupação e um limitador. Nesse evento histórico, o início da captação do coração doado se deu após 5 minutos de assistolia do doador, com heparinização, esternotomia e entrada em circulação extracorpórea. A temperatura do doador foi levada a 26 ºC, quando a cânula arterial foi redirecionada para a valva aórtica, com clampeamento distal e redução do fluxo de 3,5 L/min para 0,5 L/min, garantindo exclusivamente a perfusão coronariana.
O coração, então, continuou sendo resfriado até 16 ºC, momento em que se realizou a cardiectomia, e o órgão foi armazenado em uma cuba com Ringer lactato a 10 ºC. Foram mantidas a cânula arterial e a cânula de descompressão do ventrículo esquerdo no coração, de forma que, após a transferência para a sala ao lado, onde o receptor estava sendo posto em circulação extracorpórea, foi reiniciada a perfusão coronariana com fluxo de 0,4 L/min até o momento do implante no receptor.1
Como ainda não havia definições sobre a doação após morte encefálica (donation after brain death – DBD), a captação só se iniciou após 5 minutos de assistolia, ausência de movimentos respiratórios espontâneos e ausência de reflexos, do que se compreende que o coração foi submetido a hipoxemia por, pelo menos, 5 minutos. Esse é o conceito da doação após morte cardíaca (donation after cardiac death – DCD). Além disso, só após a confirmação da morte foi administrada a heparina, o que reservou tempo suficiente para que pequenos trombos pudessem ter se desenvolvido na circulação e microcirculação. Ademais, para que fosse possível o transplante, doador e receptor estavam em salas adjacentes, de forma que se reduzisse ao máximo o tempo de transporte e de isquemia do órgão. Os primeiros casos seguiram técnica de preservação semelhante, que, somada aos esquemas de imunossupressão ainda incipientes, contribuiu para uma baixa sobrevida dos receptores após o transplante nessas condições.2
Evolução legal e tecnológica na preservação do órgão doador
No ano seguinte ao primeiro transplante cardíaco, Henry Beecher introduziu o conceito de que o coma irreversível também poderia ser um critério legal para a definição de morte, considerando todo o dano causado com tentativas infrutíferas de ressuscitar tais pacientes e a perda de oportunidade por controvérsias na elegibilidade de tais pacientes como doadores de órgãos.3
Até 1981, houve divergências na definição de morte, afetando a inclusão do paciente com morte encefálica nos emergentes programas de doação de órgãos, até a publicação do Ato de Determinação Uniforme da Morte (UDDA), que confirmou ampla e legalmente a DBD.4 Com isso, a parada do coração para cardiectomia e transporte passou a poder ser realizada de forma controlada com soluções cardioplégicas resfriadas, praticamente extinguindo o tempo de isquemia sem resfriamento.
A preservação estática hipotérmica passou a ser o método principal de conservação do enxerto até o transporte e o implante. Assim como nas cirurgias com circulação extracorpórea e parada induzida do coração convencionais, utiliza-se uma solução cristaloide ou sanguínea para lavar o sangue contido nas coronárias e microcirculação, infundindo uma carga elevada de íons e moléculas que levam à hiperpolarização cardíaca e à estabilidade da membrana.
Para isso, após o aceite do órgão, é realizada a descompressão cardíaca através de uma incisão na cava inferior e outra no átrio esquerdo ou artéria pulmonar, seguida pelo clampeamento aórtico e infusão de solução cardioplégica resfriada. Ao garantir a adequada infusão da solução cardioplégica e parada do coração em diástole, é finalizado o explante e realizada a transferência do órgão para armazenamento, banhado em mais solução cardioplégica em um cooler resfriado com soro gelado. Nesse momento, o órgão pode ser transportado para o hospital onde o receptor está sendo preparado para o implante.
A importância do resfriamento, realizado habitualmente a 4 ºC, reside no fato de essa temperatura reduzir o metabolismo celular a 10-12% do normal e diminuir a atividade de enzimas autolíticas que induziriam a apoptose.5 Foram desenvolvidas dezenas de soluções cardioplégicas para o transplante cardíaco, mas, atualmente, a solução cardioplégica mais utilizada é o Custodiol® (Figura 1), ou solução de histidina-triptofano-cetoglutarato (HTK).
Figura 1. Solução de histidina-triptofano-cetoglutarato (Custodiol®).
O custodiol, também conhecido como solução de Bretschneider, é uma solução cristaloide, intracelular, que causa uma depleção do sódio, induzindo a hiperpolarização do miócito e a parada em diástole. O componente de histidina controla a acidose causada pelos metabólitos da anaerobiose do período de isquemia, o triptofano estabiliza a membrana celular, o cetoglutarato aumenta a produção de adenosina trifosfato (ATP) na reperfusão, e o manitol controla a osmolaridade, reduzindo o edema celular e ajudando na depuração de radicais livres.6
A solução HTK, assim como as soluções Celsior ou UW (da Universidade de Wisconsin), permite um tempo ótimo de isquemia até 4 a 6 horas, o que atualmente viabiliza o transplante cardíaco entre pacientes que estão em hospitais, cidades, estados ou mesmo países diferentes. Deve-se, contudo, atentar para o fato de que tempos maiores que os preconizados aumentam o risco de disfunção primária do enxerto e mortalidade, apesar de alguns pacientes selecionados poderem ter resultados satisfatórios com tempos maiores de isquemia.7
Processo atual de captação de corações no Brasil
Atualmente no Brasil, a regulamentação, o controle e o monitoramento de todo o processo de doação e transplantes são realizados pelo Sistema Nacional de Transplantes, responsável pelos 363 corações transplantados em 2022. No mesmo período, havia 416 pacientes cadastrados como potenciais receptores ativos ou semiativos na lista de espera por um novo coração.8
O processo de doação (Figura 2) se inicia quando (1) o hospital notifica a Central de Transplantes sobre um paciente com morte encefálica declarada e com potencial para doação. Em seguida (2), a Central repassa a notificação para a Organização de Procura de Órgãos (OPO), que (3) contacta o Hospital para avaliar a viabilidade do doador e (4) sinaliza de volta à Central em caso positivo. A OPO, então, (5) encaminha material para a identificação do antígeno leucocitário humano (HLA) do doador para o laboratório de imunogenética, que (7) informa o resultado à Central de Transplantes. Esta (8), munida da lista definitiva de receptores de cada órgão, contata as equipes de transplante conforme a prioridade para que (9) realizem o transplante.
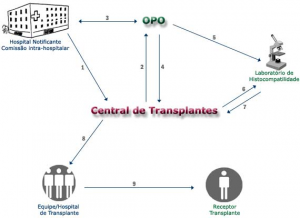
Figura 2. Fluxograma de notificação de doação envolvendo a Central de Transplantes e a Organização de Procura de Órgãos (Fonte: Secretaria de Estado de Saúde de São Paulo).
No caso do coração, a lista brasileira é dividida por tipo sanguíneo e ordenada conforme a probabilidade de morte na fila de espera. Assim, os principais critérios para a priorização são dependência de inotrópicos, uso de balão intra-aórtico ou dispositivos de assistência circulatória de curta duração, ventilação mecânica ou determinação de câmara técnica.9 Uma vez encontrados os potenciais receptores de mesmo tipo sanguíneo e peso compatível, a Central e as equipes de transplante devem levar em consideração a distância e a logística disponível para a captação e o transporte do órgão.
Após a alocação das equipes de transplante (Figura 3 – passo 1), estas (2) se encaminham até o hospital do doador. Na captação (3), o paciente é preparado e realizam-se esternotomia, abertura do pericárdio e avaliação do coração. Esta inclui analisar o tamanho do coração, sua compatibilidade com o receptor, checagem de possíveis lesões preditoras de disfunção, como lesões coronarianas, contusões ou petéquias, e comunicação com a equipe responsável pelo implante para o aceite ou não do órgão. Após a confirmação, a equipe de implante convoca o receptor para o preparo no centro cirúrgico, enquanto a equipe de captação retira o órgão, (4) realiza o clampeamento, infunde a cardioplegia e armazena o coração a frio para o transporte (5). Somente após a chegada do coração (6) doado ao centro onde será realizado o implante é canulada a circulação extracorpórea e realizada a retirada do coração. O coração é, então, (7) implantado, a aorta é desclampeada, e a cardioplegia é lavada, até que o órgão volte a bater novamente, geralmente de forma espontânea.
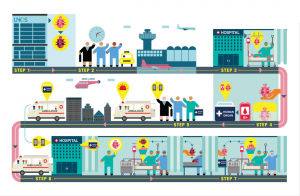
Figura 3. Fluxograma do processo de captação, transporte e implante no transplante de coração (Fonte: Universidade de Michigan, Infomen).
Considerando-se que o custodiol permite uma proteção ideal de até 4 horas de isquemia fria, captações até 190 km devem dispor de transporte terrestre e/ou aéreo (helicóptero) e, acima dessa distância, idealmente deve-se dispor de transporte terrestre e aéreo (avião) para a realização da captação.10 Esse processo deve ser checado e garantido pelo coordenador do transplante, geralmente o cirurgião responsável pela captação. Além disso, é extremamente importante a comunicação e sincronia entre os times de captação e implante, para que o tempo de isquemia seja minimizado ao máximo. Para isso, o time de captação precisa estimar o tempo de clampeamento, proteção, transporte e chegada ao centro cirúrgico, onde o time de implante já deve ter o receptor anestesiado e preparado para, logo em seguida, iniciar a circulação extracorpórea.
Novos dispositivos de preservação do coração
Embora avanços significativos tenham permitido tempos maiores de isquemia, novas iniciativas vêm introduzindo melhorias no controle das condições do enxerto até o implante, que podem ampliar ainda mais os horizontes para a captação a distância.
O sistema de transporte Paragonix SherpaPak (Figura 4) consiste em um recipiente de armazenamento de uso único que controla a temperatura do órgão, mantido estéril no seu interior em um banho de solução cardioplégica entre 4 e 8 ºC, diferentemente do transporte habitual em soro gelado, em que a temperatura não é controlada de forma precisa e contínua. Embora os estudos iniciais mostrem magnitudes de efeito ainda tímidas nos primeiros dias, especialmente na incidência de disfunção ventricular, ensaios clínicos com um ano de seguimento sugerem discreta melhor função biventricular nos pacientes que tiveram a temperatura controlada durante o transporte usando o Paragonix.11
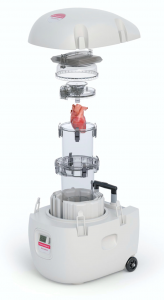
Figura 4. Sistema de transporte cardíaco Paragonix SherpaPak.
Recentemente, foi aprovada pela Food and Drug Adminstration (FDA) uma plataforma que permite a conservação do coração batendo em normotermia: o TransMedics Organ Care System (Figuras 5 e 6). Neste dispositivo, após cardioplegia e cardiectomia, o coração é canulado na aorta para reperfusão, no ventrículo direito via pulmonar para drenagem com cavas laçadas e no átrio esquerdo para descompressão, conectando a um circuito do próprio recipiente de armazenamento, preenchido com o sangue colhido do doador. Após a reperfusão, busca-se normotermia e ritmo sinusal, podendo cardioverter o doente ou utilizar fios de marca-passo epicárdicos.12 Durante o transporte, o circuito permite ainda a coleta de gasometria e lactato, considerado um preditor com alta acurácia de disfunção em até 30 dias.13
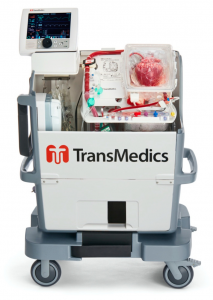
Figura 5. TransMedics Organ Care System para armazenamento e transporte em normotermia e com coração batendo.
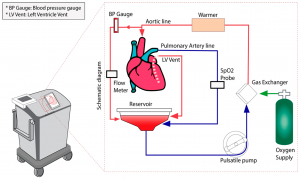
Figura 6. Circuito do Organ Care System: o sangue oxigenado é bombeado passando por um oxigenador e um trocador de calor até a raiz da aorta, é drenado desoxigenado pelo seio coronariano, átrio direito, ventrículo direito e artéria pulmonar, até voltar para o reservatório. Há, ainda, uma cânula de descompressão no ventrículo esquerdo, posicionada pelo átrio esquerdo, que também drena para o mesmo reservatório.14
Estudos comparando o TransMedic Organ Care System à conservação estática a frio ainda não mostraram diferença em mortalidade e na incidência de rejeição, disfunção ou eventos cardiovasculares ou no tempo de internação em UTI.15,16
O sistema de preservação ex-vivo (XVIVO Heart Preservation System – Figura 7), em que o coração é perfundido com solução cardioplégica a 8 ºC rica em nutrientes, hormônios e hemácias, está em fases avançadas de ensaios clínicos. Preenche-se o reservatório com 2,5 L de perfusato e 500 mL de concentrado de hemácias irradiado e filtrado. Após a cardiotomia, a aorta é canulada e o coração é submerso na solução do reservatório, que atinge hematócrito próximo a 15%. O sangue é bombeado por uma bomba centrífuga, passando por um oxigenador de membrana, um filtro leucocitário e um trocador de calor, até a raiz da aorta, e o sangue venoso drenado pelo seio coronariano até a artéria pulmonar cai no reservatório, de onde é drenado para recircular pelo sistema (Figura 7), com um fluxo que varia entre 150 e 250 mL/min.17

Figura 7. Aspecto externo do sistema de preservação XVIVO®.
Este ano, foi relatado um caso com preservação de mais de 12 horas utilizando o sistema XVIVO a bordo de um voo comercial que percorreu 6.750 km através do Atlântico, realizado com sucesso, bom índice cardíaco no implante e alta hospitalar após 30 dias.18 Dados do estudo PRESERVE, ensaio clínico randomizado controlado multicêntrico com 203 pacientes, ainda em andamento, foram publicados no encontro da Sociedade Internacional de Transplante de Coração e Pulmão (ISHLT) em Praga também este ano19. O resultado parcial sugere uma redução de 30,1% para 18,8% de complicações graves e de 28% para 11% em disfunção primária do enxerto nos pacientes que usaram o XVIVO20. Embora o custo seja alto e os resultados não tenham sido publicados, o sistema representa um grande avanço e esperança para transplantes a longa distância e com tempo de isquemia maior.
Como tratamento padrão-ouro para o tratamento da insuficiência cardíaca, conhecer as técnicas de preservação cardíaca e contribuir para seu desenvolvimento se mostra imperativo ao cirurgião cardiovascular que se empenha no transplante cardíaco, no tratamento da insuficiência cardíaca avançada e no manejo da assistência circulatória mecânica. A evolução das técnicas e tecnologias envolvidas na conservação pode ampliar o tempo aceitável para conservação e os limites geográficos da captação, trazendo esperança a cada vez mais pacientes na hoje tão demorada e fatal fila do transplante cardíaco.
REFERÊNCIAS
1 Barnard CN. The operation. A human cardiac transplant: an interim report of a successful operation performed at Groote Schuur Hospital, Cape Town. S Afr Med J. 1967;41(48):1271-4.
2 Stolf NAG. History of heart transplantation: a hard and glorious journey. Braz J Cardiovasc Surg. 2017;5(32):423-7. doi: 10.21470/1678-9741-2017-0508.
3 Beecher HK. A definition of irreversible coma. JAMA. 1968;205(6):337. doi: 10.1001/jama.1968.03140320031009.
4 Sade RM. Brain death, cardiac death, and the dead donor rule. J S C Med Assoc. 2011;4(107):146-9.
5 Southard JH, Belzer FO. Organ preservation. Annu Rev Med. 1995;46:235-47.
6 Bretschneider HJ. Myocardial protection. Thorac Cardiovasc Surg. 1980;28(5):295-302. doi: 10.1055/s-2007-1022099.
7 Smith J, O’Brien KD, Dardas TF, Fishbein DP, Verrier ED, Stempien-Otero A, et al. Excellent long-term survival with extended ischemic time in orthotopic heart transplantation. J Heart Lung Transplant. 2014;33: 117-8.
8 Sistema Nacional de Transplantes (SNT). Ministério da Saúde. Relatório de Doação (Brasil) – Evolução 2001 – 2023 [Internet]. Brasília. 2023 Aug 5 [Cited 2024 Aug 14]. Available from: https://www.gov.br/saude/pt-br/composicao/saes/snt/estatisticas/doacao-serie-historica/relatorio-de-doacao-brasil-evolucao-2001-2023/view
9 Bacal F, Marcondes-Braga FG, Rohde LEP, Xavier Júnior JL, Brito F de S, Moura LAZ, et al. 3ª Diretriz Brasileira de Transplante Cardíaco. Arq Bras Cardiol. 2018;2(111):230-89. Doi: 10.5935/abc.20180153.
10 Lynch RJ, Mathur AK, Hundley JC, Kubus J, Pietroski RE, Mattice BJ, et al. Improving organ procurement practices in Michigan. Am J Transplant. 2009;9(10):2416-23. Doi: 10.1111/j.1600-6143.2009.02784.x.
11 Radakovic D, Karimli S, Penov K, Schade I, Hamouda K, Bening C, et al. First clinical experience with the novel cold storage SherpaPakTM system for donor heart transportation. J Thorac Dis. 2020;12(12):7227-35. Doi: 10.21037/jtd-20-1827.
12 Hess NR, Ziegler LA, Kaczorowski DJ. Heart donation and preservation: historical perspectives, current technologies, and future directions. J Clin Med. 2022;11(19):5762. doi: 10.3390/jcm11195762.
13 Hamed A, Tsui S, Huber J, Lin R, Poggio EC, Ardehali A. Serum lactate is a highly sensitive and specific predictor of post cardiac transplant outcomes using the organ care system. J Heart Lung Transplant. 2009;2(28):S71.
14 Kothari P. Ex-vivo preservation of heart allografts—an overview of the current state. J Cardiovasc Dev Dis. 2023;10(3):105. doi: 10.3390/jcdd10030105.
15 Ardehali A, Esmailian F, Deng M, Soltesz E, Hsich E, Naka Y, et al. Ex-vivo perfusion of donor hearts for human heart transplantation (PROCEED II): a prospective, open-label, multicentre, randomised non-inferiority trial. Lancet. 2015;385(9987):2577-84. doi: 10.1016/s0140-6736(15)60261-6.
16 Chan JL, Kobashigawa JA, Reich HJ, Ramzy D, Thottam MM, Yu Z, et al. Intermediate outcomes with ex-vivo allograft perfusion for heart transplantation. J Heart Lung Transplant. 2017;36(3):258-63. doi: 10.1016/j.healun.2016.08.015.
17 Nilsson J, Jernryd V, Qin G, Paskevicius A, Metzsch C, Sjöberg T, Steen S. A nonrandomized open-label phase 2 trial of nonischemic heart preservation for human heart transplantation. Nat Commun. 2020;11(1):1-1. doi: 10.1038/s41467-020-16782-9.
18 Lebreton G, Leprince P. Successful heart transplant after 12 h preservation aboard a commercial flight. Lancet. 2024;403(10431):1019. doi: 10.1016/s0140-6736(24)00258-7.
19 Nilsson J, Jernryd V, Qin G, Paskevicius A, Metzsch C, Sjöberg T, Steen S. A nonrandomized open-label phase 2 trial of nonischemic heart preservation for human heart transplantation. Nat Commun. 2020;11(1):2976.
20 Rega F, Lebreton G, Para M, Michel S, Schramm R, Begot E, Vandendriessche K, Kamla C, Gerosa G, Berman M, Boeken U, Clark S, Ranasinghe A, Ius F, Forteza A, Hennig F, Vinter S, Zuckermann A, Knosalla C, Dellgren G, Wallinder A. Non-ischemic preservation of the Donor Heart in Heart Transplantation System for Hypothermic Ox43(4):S11.