Para muitos, uma descarga elétrica é sinônimo de perigo, mas, para aqueles que dependem de um dispositivo cardíaco eletrônico implantável (DCEI), cada estímulo elétrico representa um sopro de vida renovado. Seja na forma de marca-passos (MPs), cardioversores-desfibriladores implantáveis (CDIs) ou dispositivos de terapia de ressincronização cardíaca (DTRCs), os DCEIs materializam a profundidade da frase do pioneiro da energia elétrica, Nikola Tesla: “Se você quiser descobrir os segredos do Universo, pense em termos de energia, frequência e vibração”. Uma vez que o ser humano é um universo complexo, para aqueles que utilizam um DCEI, o dispositivo, por meio da energia, possibilita uma frequência cardíaca que determina a vibração miocárdica e, consequentemente, a propulsão da vida. Contudo, essa vitalidade pode ser comprometida por um desafio significativo e preocupante: as infecções de DCEIs.
Figura 1 – Ilustra a presença vital do dispositivo
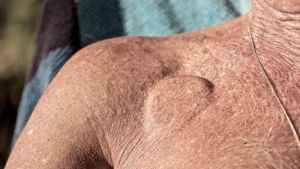
Figura 2 – Mostra sinais de infecção
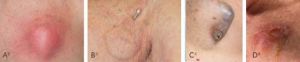
Na Figura 2, observam-se padrões distintos de infecções locais de DCEI. Analisando-os, pode parecer razoável pensar que um tratamento conservador com antibioticoterapia, associado ou não a uma abordagem local para controle da infecção, seria uma opção custo-efetiva e eficaz. De fato, antes do uso rotineiro das técnicas que foram se desenvolvendo, as infecções dos dispositivos eram tratadas conservadoramente, apenas com antibióticos. Porém, as evidências mostraram que essa não é, nem de longe, uma opção razoável. Uma revisão sistemática de 2018, publicada no Brazilian Journal of Cardiovascular Surgery, constatou que o tratamento conservador apenas com antibióticos está ligado a uma taxa de mortalidade muito alta, o que levou os médicos a reconsiderarem as alternativas terapêuticas[1]. Um dos artigos relatou que a taxa de mortalidade entre os pacientes tratados apenas com antibióticos foi de 41%[2]. Isso significa que, a cada três pacientes internados recebendo tratamento antibiótico isolado para infecção de DCEI, um ou dois morreriam em decorrência do quadro. Sem dúvidas, esse é um dado alarmante. Esforços, portanto, foram direcionados para entender o arsenal terapêutico disponível e identificar as melhores estratégias para o manejo dos pacientes com infecção de DCEI.
EPIDEMIOLOGIA
Um dos maiores registros de infecção de DCEI é de um estudo dinamarquês que analisou a incidência da infecção entre 97.750 pacientes submetidos a um total de 128.045 procedimentos de implantação ou substituição. Os riscos vitalícios foram de 1,2, 1,9, 2,2 e 3,4% para MP, CDI, DTRC sem capacidade de desfibrilação e DTRC com capacidade de desfibrilação, respectivamente. As taxas de infecção foram mais baixas durante a implantação inicial, aumentando de 1,5 a 3 vezes nos procedimentos de revisão ou substituição[3]. Apesar de ainda ser considerável, a mortalidade hospitalar relacionada aos DCEIs tem mostrado uma tendência de queda. Entre os 27.257 casos de endocardite infecciosa relacionada ao dispositivo (EI-DCEI) na Amostra Nacional de Pacientes Internados dos Estados Unidos de 2003 a 2017, a análise longitudinal revelou uma redução significativa na mortalidade de 15 para 9,7%. No mesmo período, a proporção anual de casos de EI-CIED aumentou de 1,7 para 4,8%, o que está associado a um maior uso de DCEIs[4]. Uma revisão sistemática identificou que a mortalidade durante a internação de pacientes com infecção relacionada ao DCEI variou de 2 a 10,8% nos estudos, com média de 5,4%. As principais causas de morte hospitalar identificadas foram sepse, falência multiorgânica, disfunção ventricular grave, acidente vascular cerebral, parada cardiorrespiratória, insuficiência renal, choque séptico e insuficiência respiratória aguda[1].
Investigação diagnóstica
“Persistem incertezas sobre o papel de várias medidas preventivas, diagnósticas e de tratamento.” Com essa justificativa, em 2020, a European Heart Rhythm Association (EHRA) publicou o “European Heart Rhythm Association (EHRA) international consensus document on how to prevent, diagnose, and treat cardiac implantable electronic device infections”, apoiado pela Heart Rhythm Society (HRS), Asia Pacific Heart Rhythm Society (APHRS), Latin American Heart Rhythm Society (LAHRS), International Society for Cardiovascular Infectious Diseases (ISCVID) e European Society of Clinical Microbiology and Infectious Diseases (ESCMID), em colaboração com a European Association for Cardio-Thoracic Surgery (EACTS)[5]. Nesse documento, novos critérios diagnósticos foram sugeridos, baseados nas evidências mais recentes, para orientar a conduta dos profissionais que lidam com infecções de DCEI. Antes de discutirmos especificamente a investigação diagnóstica, relembro, com a figura abaixo, as formas como as infecções de DCEI podem ocorrer.
Figura 3
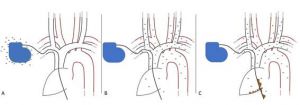
Vale ressaltar que as formas infecciosas anteriormente representadas podem coexistir em um mesmo quadro clínico. Uma infecção sistêmica pode estar associada a uma infecção de loja. Além disso, alguns autores referem infecção sistêmica como sinônimo de EI-DCEI e infecção do eletrodo. A infecção superficial da ferida operatória também deve ser diferenciada das outras formas de infecção supracitadas.
Com base nisso, a fim de aumentar a sensibilidade para o diagnóstico de infecção por DCEI, a EHRA desenvolveu os Critérios Internacionais de Infecção por DCEI de 2019, que podem ser acessados pelo seguinte link: https://academic.oup.com/view-large/377267499. Para fins terapêuticos, o documento separa as formas de infecção em infecção de loja e infecção sistêmica do DCEI e endocardite infecciosa sem infecção local, como descrito a seguir:
“Infecção clínica da loja/gerador do DCEI ‘Definitiva’ = a loja do gerador mostra inchaço, eritema, calor, dor e formação de secreção/fístula purulenta OU deformação da loja, aderência e ameaça de erosão OU exposição de gerador ou eletrodos proximais. EI-DCEI ‘Definitiva’ = presença de dois critérios maiores ou um critério maior + três critérios menores. EI-DCEI ‘Possível’ = presença de um critério maior + um critério menor ou três critérios menores. Diagnóstico EI-DCEI ‘Rejeitada’ = pacientes que não atenderam aos critérios acima mencionados para EI.”
Veja os diferentes padrões de infecção de loja de DCEI na Figura 2.
Os critérios maiores incluem microbiologia com hemoculturas positivas para microrganismos típicos encontrados em infecção por DCEI e/ou EI (estafilococos coagulase-negativa, Staphylococcus aureus) e imagens positivas para infecções de DCEI e/ou EI, que incluem ecocardiograma com sinais de vegetação em válvulas ou eletrodos. Os critérios menores incluem febre e outras comorbidades que podem estar associadas ao quadro. Todos os critérios podem ser vistos na íntegra no link disponibilizado anteriormente.
Outras ferramentas devem ser consideradas em caso de suspeita de complicações ou dúvida diagnóstica, como tomografia computadorizada por emissão de pósitrons com fluorodesoxiglicose (FDG PET/CT) e tomografia computadorizada por emissão de fóton único de glóbulos brancos (WBC SPECT/CT), especialmente quando há hemoculturas positivas e ecocardiografia negativa.
Um passo para trás, para dar dois passos para a frente
O 2017 HRS Expert Consensus Statement on Cardiovascular Implantable Electronic Device Lead Management and Extraction[6] e o mais recente documento internacional da ERHA, além de outras sociedades médicas de cardiologia, são claros quanto à conduta diante de uma infecção definitiva de DCEI (sistêmica ou local): remoção completa de todas as partes do sistema, incluindo eletrodos abandonados, eletrodos epicárdicos e fragmentos de eletrodos, idealmente dentro de três dias. Em um estudo que evidenciou a importância dessa conduta, incluindo 415 pacientes com infecção de DCEI, aqueles que não foram submetidos à remoção do dispositivo apresentaram um aumento de sete vezes na mortalidade em 30 dias em comparação aos que passaram pela remoção do dispositivo (HR 6,97, IC 95% 1,36-35,6). A remoção imediata do DCEI (em contraste com a remoção após falha da terapia antimicrobiana ou nenhuma remoção) foi associada a uma redução de três vezes na mortalidade em um ano (HR 0,35, IC 95% 0,16-0,75)[7]. Fica evidente, portanto, que retirar o dispositivo é o primeiro passo (para trás?) para o sucesso terapêutico.
Alternativas já foram tentadas para evitar “um passo para trás”, como antibioticoterapia associada ao reposicionamento do mesmo gerador, antibioticoterapia combinada com medidas locais e irrigação fechada, e técnica de implante subpeitoral para o tratamento de infecções restritas à loja do gerador[8]. No entanto, com as crescentes evidências a favor da remoção completa do dispositivo, este tem sido o novo paradigma no tratamento das infecções de DCEI. Em infecções superficiais da ferida logo após a implantação, troca do dispositivo ou cirurgia de revisão, não é necessária a remoção do dispositivo e do eletrodo.
Como discutido anteriormente, a EHRA não diferencia, em termos de diagnóstico, a infecção sistêmica da endocardite infecciosa (mesmo quando não há envolvimento definido do sistema DCEI). Isso ocorre porque, para fins terapêuticos, a abordagem é semelhante: remoção completa de todo o sistema mais antibioticoterapia.
As recomendações completas, bem como as instruções para a remoção de todo o sistema, podem ser vistas no link https://academic.oup.com/view-large/377267522.
A ERHA afirma ainda que a antibioticoterapia é complementar à extração do sistema DCEI e que faltam estudos randomizados para orientar a escolha de antibióticos em infecções de DCEI. Os esquemas sugeridos podem ser verificados no link a seguir: https://academic.oup.com/view-large/377267531.
A indicação de reimplante deve ser sempre reavaliada após a retirada do DCEI. O reimplante deve ser adiado até que os sinais e sintomas de infecção local e sistêmica sejam resolvidos ou até que as hemoculturas sejam negativas por pelo menos 72 horas após a extração, se possível.
O mundo real
Em sua obra A República, Platão discute a Teoria das Formas ou Teoria das Ideias, diferenciando o mundo sensível (o mundo real) do mundo inteligível (o mundo ideal). Para Platão, o mundo real é imperfeito e em constante mudança, enquanto o mundo ideal, composto pelas Formas, é eterno e perfeito. Se considerarmos o mundo ideal como o “mundo das diretrizes” (sem a pretensão de ver a medicina como uma ciência exata, eterna e perfeita), percebemos uma grande discrepância no mundo real, especialmente no que diz respeito à infecção de DCEI.
Um artigo publicado no European Heart Journal em 2023 enumerou diversos estudos que corroboram esse entendimento[9]. Os dados mostraram que é improvável que 40 a 90% dos pacientes com infecções de DCEI sejam submetidos à extração do dispositivo. Em um dos estudos, que analisou pacientes com EI-DCEI entre 2016 e 2019, apenas 11,5% foram submetidos à extração do dispositivo. Esse dado contrasta com uma pesquisa mundial realizada pela EHRA em 2018, na qual 62% dos médicos (n = 242) afirmaram que removeriam completamente o dispositivo em casos de suspeita de infecção de loja (na ausência de contraindicações ou fatores de alto risco). Outros estudos revelaram que muitos médicos percebem a extração como um procedimento complexo (44%) e de alto risco de mortalidade (77%), apesar de essa percepção não refletir a realidade. Dados de um registro europeu mostraram uma taxa de sucesso de 96,7% para a extração transvenosa de eletrodos e uma taxa de mortalidade relacionada ao procedimento de apenas 0,5%. Outra série de casos relatou altas taxas de sucesso tanto em pacientes com implantes há mais de 10 anos (95,6%) quanto naqueles com implantes mais recentes (99,6%).
Diante disso, são necessários esforços para transformar as informações de diretrizes em práticas clínicas que gerem resultados de impacto, com aumento de sobrevida e redução de morbidade e mortalidade aos pacientes.
O artigo do European Heart Journal citado anteriormente traz também um resumo gráfico das principais informações sobre as barreiras encontradas e as estratégias-chave no manejo de pacientes com infecção de DCEI, que pode ser visto na figura a seguir.
Figura 4
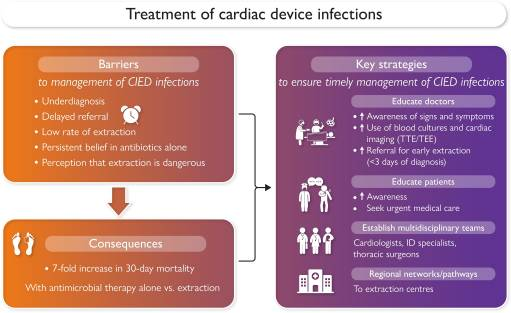
Dentro desse contexto, também se torna fundamental seguir o princípio bioético primum non nocere, que significa “primeiro, não prejudicar”, priorizando a prevenção de possíveis danos aos pacientes.
Prevenção
As medidas de prevenção de infecções relacionadas aos DCEIs foram revisadas e publicadas em 2021 pelo Europace na diretriz “Prevention of cardiac implantable electronic device infections: guidelines and conventional prophylaxis”[10]. O documento destaca que a prevenção dessas infecções envolve a avaliação de riscos e a adoção de medidas para evitar complicações em diversas etapas, de forma oportuna, antes, durante e após o procedimento de implantação.
Portanto, a avaliação do risco de infecção aumenta a conscientização sobre os fatores de risco que podem ser eliminados ou reduzidos por meio de várias ações preventivas em diferentes níveis. Muitos dos fatores de risco conhecidos para infecções de DCEI são modificáveis, permitindo a implementação de medidas preventivas para reduzir esses riscos. Entre essas medidas, a diretriz recomenda atenção especial à terapia anticoagulante ou antiplaquetária em curso, pois hematomas no local de implantação estão associados a um risco significativamente maior de infecção de DCEI.
Em relação à profilaxia antibiótica, os regimes posológicos são semelhantes aos utilizados para cirurgia cardíaca (p. ex., cefazolina 2 g [3 g para aqueles com peso > 120 kg] por via intravenosa dentro de 60 minutos após a incisão cirúrgica). O uso de envelopes impregnados com antibióticos (minociclina/rifampicina) deve ser reservado para pacientes com risco aumentado de infecção de DCEI (como aqueles com insuficiência renal, doença pulmonar obstrutiva crônica, insuficiência cardíaca e diabetes) no momento da implantação ou substituição do gerador.
Encargos financeiros
As infecções de DCEI representam um peso importante de encargos financeiros para os sistemas de saúde. Um estudo identificou que os custos médicos médios anuais foram 2,4 vezes mais elevados para pacientes com DCEI com uma infecção, em comparação àqueles sem infecção[11]. Em números absolutos, outro estudo identificou que as infecções aumentam o custo do cuidado por paciente de $62,256 para $110,141 para implantes iniciais e de $64,810 para $110,332 para implantes de substituição. Outros custos indiretos incluem perda de produtividade do paciente e de cuidadores familiares[12].
Considerações finais
Preocupadas com os dados que refletem a realidade do manejo de infecções de DCEI, várias sociedades médicas desenvolveram materiais educativos para melhorar a comunicação entre pacientes e médicos, visando ao diagnóstico precoce e ao encaminhamento para centros especializados.
Por exemplo, o CIED Infection Summit, liderado pela American Heart Association (AHA), em 2022, por meio da National CIED Infection Initiative, criou documentos e outros materiais educativos, como webinários gravados e podcasts, com o lema “Preenchendo lacunas na conscientização, detecção e tratamento adequado de infecções de DCEI”. Abaixo, uma imagem retirada de um desses documentos ilustra essa preocupação.
Figura 5

Os materiais educativos da AHA podem ser acessados através do link: https://www.heart.org/en/professional/quality-improvement/national-cied-infection-initiative/
Por fim, pode-se concluir que, no caso de infecção de DCEI, “um passo para trás” (a retirada de todo o sistema DCEI) é essencial para garantir melhor sobrevida e reduzir a morbidade e mortalidade dos pacientes (“dois passos para a frente”).
REFERÊNCIAS
1 Menezes Júnior ADS, Magalhães TR, Morais AOA. Percutaneous lead extraction in infection of cardiac implantable electronic devices: a systematic review. Braz J Cardiovasc Surg. 2018;33(2):194-202.
2Cacoub P, Leprince P, Nataf P, Hausfater P, Dorent R, Wechsler B, Bors V, et al. Pacemaker infective endocarditis. Am J Cardiol. 1998 Aug 15;82(4):480-4.
3Olsen T, Jørgensen OD, Nielsen JC, Thøgersen AM, Philbert BT, Johansen JB. Incidence of device-related infection in 97 750 patients: clinical data from the complete Danish device-cohort (1982-2018). Eur Heart J. 2019;40:1862.
4Khaloo P, Uzomah UA, Shaqdan A, Ledesma PA, Galvin J, Ptaszek LM, Ruskin JN. Outcomes of patients hospitalized with cardiovascular implantable electronic device-related infective endocarditis, prosthetic valve endocarditis, and native valve endocarditis: a nationwide study, 2003 to 2017. J Am Heart Assoc. 2022;11:e025600.
5Blomstrom-Lundqvist C, Traykov V, Erba PA, Burri H, Nielsen JC, Bongiorni MG, et al. European Heart Rhythm Association (EHRA) international consensus document on how to prevent, diagnose, and treat cardiac implantable electronic device infections-endorsed by the Heart Rhythm Society (HRS), the Asia Pacific Heart Rhythm Society (APHRS), the Latin American Heart Rhythm Society (LAHRS), International Society for Cardiovascular Infectious Diseases (ISCVID), and the European Society of Clinical Microbiology and Infectious Diseases (ESCMID) in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2020;41:2012-32.
6Kusumoto FM, Schoenfeld MH, Wilkoff BL, Berul CI, Birgersdotter-Green UM, Carrillo R, et al. 2017 HRS expert consensus statement on cardiovascular implantable electronic device lead management and extraction [published correction appears in Heart Rhythm. 2021 Oct;18(10):1814]. Heart Rhythm. 2017;14(12):e503-e551.
7Le KY, Sohail MR, Friedman PA, Uslan DZ, Cha SS, Hayes DL, et al.; Mayo Cardiovascular Infections Study Group. Impact of timing of device removal on mortality in patients with cardiovascular implantable electronic device infections. Heart Rhythm. 2011;8:1678.
8Valente AS, Pochini MC, Pinto AMR, Campagnucci VP, Marinelli I, Gandra SMA, et al. Subpectoral pacemaker implantation technique for treatment of generator pocket infection: initial study. Braz J Cardiovasc Surg. 2001;16(1):49-52.
9Atar D, Auricchio A, Blomström-Lundqvist C. Cardiac device infection: removing barriers to timely and adequate treatment. Eur Heart J. 2023 Sep 14;44(35):3323-6.
10Blomstrom-Lundqvist C, Ostrowska B. Prevention of cardiac implantable electronic device infections: guidelines and conventional prophylaxis. Europace. 2021 May 25;23(Suppl 4):iv11-9.
11Eby EL, Bengtson L, Johnson M, Burton ML, Hinnenthal J. Economic impact of cardiac implantable electronic device infections: cost analysis at one year in a large U.S. health insurer. J Med Econ. 2020 Jul;23(7):698-705.
12Sohail MR, Eby EL, Ryan MP, Gunnarsson C, Wright LA, Greenspon AJ. Incidence, treatment intensity, and incremental annual expenditures for patients experiencing a cardiac implantable electronic device infection: evidence from a large US payer database 1-year post implantation. Circ Arrhythm Electrophysiol. 2016 Aug;9(8):e003929.
9