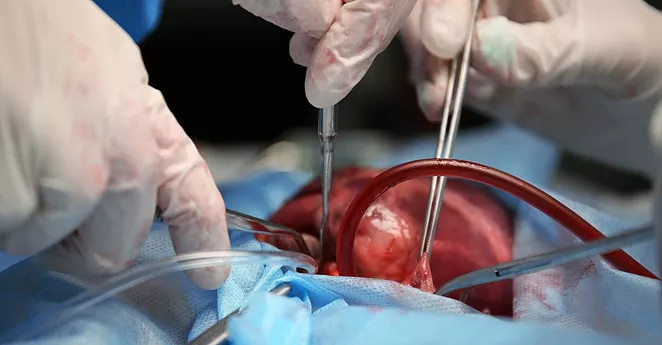
 O primeiro transplante cardíaco no mundo aconteceu em 1967, na África do Sul, e foi encabeçado pelo cirurgião cardíaco Dr. Christiaan Barnard. A primeira doadora foi Denise Darvall, uma paciente jovem de 25 anos, que havia falecido em decorrência de um acidente de carro. O receptor foi um marceneiro de 53 anos, que apresentava falência ventricular esquerda. O paciente transplantado saiu da sala de operações vivo, porém, com bloqueio atrioventricular controlado por um marca-passo. O coração transplantado teve apenas 14 minutos de isquemia durante o procedimento, tendo o paciente ficado por 117 minutos em perfusão extracorpórea. O primeiro transplantado faleceu 17 dias após o transplante cardíaco devido a pneumonia, secundária a pseudomonas. No pós-operatório, recebeu imunossupressores, como a Azatioprina, associada a injeções de esteróide, e algumas seções de radiação do coração transplantado, a cada modificação eletrocardiográfica compatível com rejeição do transplante.
O primeiro transplante cardíaco no mundo aconteceu em 1967, na África do Sul, e foi encabeçado pelo cirurgião cardíaco Dr. Christiaan Barnard. A primeira doadora foi Denise Darvall, uma paciente jovem de 25 anos, que havia falecido em decorrência de um acidente de carro. O receptor foi um marceneiro de 53 anos, que apresentava falência ventricular esquerda. O paciente transplantado saiu da sala de operações vivo, porém, com bloqueio atrioventricular controlado por um marca-passo. O coração transplantado teve apenas 14 minutos de isquemia durante o procedimento, tendo o paciente ficado por 117 minutos em perfusão extracorpórea. O primeiro transplantado faleceu 17 dias após o transplante cardíaco devido a pneumonia, secundária a pseudomonas. No pós-operatório, recebeu imunossupressores, como a Azatioprina, associada a injeções de esteróide, e algumas seções de radiação do coração transplantado, a cada modificação eletrocardiográfica compatível com rejeição do transplante.
Com o passar dos anos, houve um aumento expressivo no número de transplantes cardíacos, com melhoria nos resultados pós operatórios dos pacientes, em decorrência do desenvolvimento de novas drogas que combatem a rejeição, bem como, de novos protocolos para o seguimento do transplante. As principais indicações de transplante cardíaco são:
– Insuficiência Cardíaca Refratária ao uso de inotrópicos ou Dispositivos de Assistência Ventricular;
– Classe funcional III e IV persistentes;
– Consumo de oxigênio < 12 mL/Kg/min (em uso de betabloqueador);
– Consumo de oxigênio < 14 mL/Kg/min (sem uso de betabloqueador);
– Doença isquêmica com angina refratária e sem impossibilidade de revascularização do miocárdio;
– Arritmia ventricular persistente e refratária;
– Equivalente ventilatório de dióxido de carbono > 35 ou teste de 6 minutos de caminhada < 300m.
O casos de rejeição do enxerto são hoje responsáveis pela menor parte dos insucessos pós transplante cardíaco, que seriam os pacientes que vão a óbito após o procedimento. A biópsia endomiocárdica é o padrão ouro para o diagnóstico precoce de rejeição e o paciente pode se apresentar assintomático com o quadro. Os protocolos mais utilizados de rejeição incluem cinco classes de medicações: Corticosteróides, Inibidores de Calcineurina, antiproliferativos, Inibidores da mTOR e Terapia de Indução. Os primeiros são utilizados em doses altas logo após o transplante para evitar a rejeição aguda. Os inibidores de Calcineurina, como Tacrolimus e Ciclosporinas, auxiliam na redução da incidência de rejeição e doença vascular do enxerto. Os antiproliferativos mais utilizados são Azatioprina e Micofenolato. Já os Inibidores de mTOR mais utilizados são Sirolimus e Everolimus. As Terapias de indução consistem em uma imunossupressão mais intensiva, com anticorpos anti- linfócitos (Timoglobulina) e antagonista de Interleucina- 2 (Basiliximabe) a fim de evitar casos de rejeição precoce.
Um recente estudo identificou fatores de risco associados com maior chance de rejeição precoce de enxertos em transplantes de cardíacos. São eles: doadores do sexo feminino (sendo considerado um fator de risco independente, com maior mortalidade em receptores de ambos os sexos), maior tempo de isquemia total (que quando associado a doadores mais velhos pode dobrar a mortalidade de 1 ano de pós operatório) e utilização de suporte circulatório ventricular no pré- operatório (com aumento de mortalidade a curto e médio prazos).
Dessa forma, mesmo com os avanços no tratamento e prevenção da rejeição do enxerto no transplante cardíaco, é importante a observação de fatores de risco a fim de optar pela melhor escolha terapêutica para cada paciente, respeitando suas individualidades.
Referências:
– David Prieto, Pedro M. Correia, Manuel Batista and Manuel J. Antunes. Primary graft failure after cardiac transplantation: prevalence,prognosis and risk factors. Interactive CardioVascular and Thoracic Surgery (2018) 1–8. doi:10.1093/icvts/ivy151.
– Kobashigawa J, Zuckermann A, Macdonald P, Leprince P, Esmailian F,Luu M et al. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. J Heart Lung Transplant 2014;33:327–40.
– Lund LH, Edwards LB, Kucheryavaya AY, Dipchand AI, Benden C, Christie JD et al. The Registry of the International Society for Heart and Lung Transplantation: Thirtieth Official Adult Heart Transplant Report2013. J Heart Lung Transplant 2013;32:951–64.
– Isaac D. Primary cardiac graft failure: defining, predicting, preventing. J Heart Lung Transplant 2013;32:1168–9.
– Stewart S, Winters GL, Fishbein MC, Tazelaar HD, Kobashigawa J, Abrams J et al. Revision of the 1990 working formulation for the standardization of nomenclature in the diagnosis of heart rejection. J Heart Lung Transplant 2005;24:1710–20.
– Lund LH, Edwards LB, Kucheryavaya AY, Benden C, Dipchand AI, Goldfarb S et al. The Registry of the International Society for Heart and Lung Transplantation: thirty-second Official Adult Heart Transplantation Report-2015. Focus theme: early graft failure. J Heart Lung Transplant 2015;34:1244–54.
– Iyer A, Kumarasinghe G, Hicks M, Watson A, Gao L, Doyle A et al. Primary graft failure after heart transplantation. J Transplant 2011;2011: 1–68.
– D’Alessandro C, Golmard JL, Barreda E, Laali M, Makris R, Luyt CE et al. Predictive risk factors for primary graft failure requiring temporary extra-corporeal membrane support after cardiac transplantation in adults. Eur J Cardiothorac Surg 2011;40:962–9.
– Sandrigo Mangini, Bárbara Rubim Alves, Odílson Marcos Silvestre, Philippe Vieira Pires,Lucas José Tachotti Pires, Milena Novaes Cardoso Curiati, Fernando Bacal. Transplante cardíaco: revisão. einstein. 2015;13(2):310-8. DOI: 10.1590/S1679-45082015RW3154.
2
