A insuficiência cardíaca (IC) é uma anormalidade da função cardíaca decorrente da inabilidade do coração de atender a demanda metabólica tecidual1. Dentre suas classificações ela pode ser estratificada como sistólica e diastólica. Na insuficiência cardíaca sistólica, há redução da fração de ejeção de forma que o volume sistólico e consequentemente o débito cardíaco não são suficientes para atender à demanda metabólica do organismo. Por sua vez, na insuficiência diastólica, alterações no relaxamento ventricular acarretam maior dificuldade no enchimento do ventrículo e para que isso ocorra, se torna necessário pressão de enchimento mais elevada.
A IC é marcada por alterações da função ventricular esquerda, aumento da resposta neuroendócrina e manifestações como intolerância aos esforços, retenção de volume e elevação da mortalidade1. Sua etiologia é ampla, incluindo doença arterial coronariana, hipertensão arterial sistêmica, cardiopatias congênitas, miocardite, arritmias, valvopatias, diabetes e obesidade, causas que correspondem a 21% das internações hospitalares no Brasil2,3.
Seguramente, a IC registra números impactantes graças à escalada de sua prevalência, em parte atribuída ao sucesso no manejo de pacientes infartados, elevando sua sobrevida aliada ao aumento da longevidade da população, sendo a IC comum em indivíduos a partir dos 65 anos, o que gera relevante impacto econômico3. Estima-se que 26 milhões de pessoas no mundo apresentam IC, sendo 5,8 milhões somente nos Estados Unidos, onde a incidência anual é de aproximadamente 650 mil casos, com mortalidade anual superior a 300 mil pessoas e impacto financeiro superior a 40 bilhões de dólares em custos médicos, além da queda de produtividade3,4. Vale ressaltar que metade dos indivíduos acometidos falece cinco anos após o diagnóstico, com mortalidade anual superando a de todos os tipos de câncer combinados3,4.
Ainda em relação aos Estados Unidos, 50% dos pacientes com IC possuem fração de ejeção reduzida (ICFEr) e, destes, possivelmente 10% possuem sintomas avançados com classe funcional IIIB a IV da New York Heart Association (NYHA)4. Tal questão exige intervenções médicas, inicialmente terapia farmacológica que eleva a função cardíaca e atenua sintomas.
Na IC com fração de ejeção reduzida, podemos administrar drogas da classe dos inibidores da enzima conversora de angiotensina II (IECA), betabloqueadores, antagonistas dos receptores mineralocorticoides e inibidores da neprilisina e dos receptores da angiotensina, sendo estes responsáveis por redução da mortalidade, melhora de sintomas e redução de re-hospitalizações; além de outras classes que não reduzem mortalidade global, mas melhoram a sintomatologia, como ivabradina, digitálicos, diuréticos de alça e tiazídicos, nitrato e hidralazaina (a combinação destes últimos mostrou diferença de eficácia quando à raça, sendo redutor de mortalidade total em 43% dos pacientes autodeclarados negros classificados NYHA III-IV)5. A abordagem inicial é instituída com terapia tripla que contenha IECA ou bloqueador do receptor da angiotensina II (BRA), betabloqueador e antagonista dos receptores mineralocorticoides5.
Já na IC com fração de ejeção preservada, ainda não há estudos convincentes que apontem redução da mortalidade como desfecho isolado, porém os diuréticos de alça e tiazídicos podem ser empregados para redução de sintomas congestivos, sendo classe I e nível de evidência B5. A espironolactona e BRAs quando instituídos para redução de hospitalizações, possuem classe e nível de evidência IIA e B; IIB e B, respectivamente5.
Todavia, o transplante cardíaco é o tratamento de escolha para os pacientes com IC terminal, entretanto se defronta com o baixo número de doadores e diversos pacientes permanecem dependentes de inotrópicos intravenosos até serem submetidos ao transplante ou falecerem. Nesta conjuntura, os dispositivos de assistência circulatória mecânica surgem como alternativas3,4.
Os dispositivos de assistência circulatória consistem em bombas mecânicas produzidas com o intuito de auxiliar ou até mesmo substituir a função ventricular, seja esta direita, esquerda ou biventricular (Figura 1), em que quatro fatores são fundamentais: o local da bomba na cavidade cardíaca; qual dos ventrículos especificamente está envolvido ou se ambos estão sendo assistidos; qual o mecanismo da bomba e o período de suporte, ou seja, temporário ou de longo prazo6. Os dispositivos temporários, aqueles instituídos por dias ou semanas, são bombas extra ou paracorpóreas, enquanto os de longo prazo permanecem meses a anos no paciente e são instalados dentro do corpo, sendo, portanto, intracorpóreos6. As indicações podem ser divididas em três grupos: ponte para recuperação, ponte para transplante e terapia de destino6.
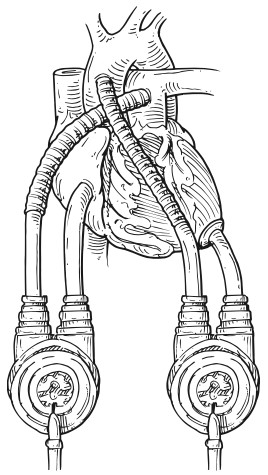
Figura 1. Thoratec PVAD em configuração biventricular.
Fonte: Kouchoukos NT et al.7.
A ponte para recuperação é a aplicação mais comum de assistência circulatória mecânica nos Estados Unidos e é utilizada em pacientes acometidos por choque cardiogênico agudo ou IC descompensada refratários ao tratamento médico otimizado (TMO)6. Existe certa possibilidade de que a lesão miocárdica seja reversível com emprego temporário e curto de assistência circulatória, não mais requerendo transplante cardíaco, como lesões miocárdicas transitórias: infarto agudo do miocárdio (IAM), miocardite aguda e choque cardiogênico pós-cardiotomia3,6,8. Há uma gama de dispositivos que podem ser usados para este fim, como balões de contrapulsação intra-aórticos (BIA), dispositivos de assistência ventricular extracorpóreos e dispositivos de suporte de vida extracorpóreos, designados como oxigenação por membrana extracorpórea (ECMO)6.
Enquanto isso, a ponte para transplante é indicada para pacientes que sofreram choque cardiogênico ou cursam com IC avançada descompensada, sem resultados satisfatórios com TMO, e quando a recuperação funcional miocárdica é improvável, sendo cenário indicativo de transplante cardíaco, a exemplo de cardiomiopatia idiopática, valvar ou isquêmica crônica, miocardite ou IAM extenso6. Tais pacientes encontram-se em uso de inotrópicos intravenosos e os que não utilizam essa medicação referem sintomas em repouso, mas estão hemodinamicamente estáveis e com órgãos-alvo preservados funcionalmente6. Já pacientes instáveis hemodinamicamente e com disfunção multiorgânica podem, em casos selecionados, se beneficiar da ponte para transplante com assistência circulatória mecânica temporária e do implante de dispositivos de longo prazo, se houver melhora6. Os dispositivos utilizados como ponte para transplante em geral não ultrapassam durabilidade de 2 anos, porém apresentam considerável avanço se comparados com a década de 1980, em que a vida média dos dispositivos era de um mês3.
Pode-se definir terapia de destino como o ato de instituir assistência circulatória mecânica de longo prazo em pacientes sintomáticos crônicos e refratários, portadores de IC avançada por cardiomiopatia isquêmica ou não isquêmica irreversível, não sendo candidatos ao transplante cardíaco; desta forma, o suporte torna-se a alternativa permanente ao paciente6. Entretanto, ainda existe a meta de desenvolver uma assistência circulatória mecânica de uso permanente em larga escala que seja: segura, confiável e que assegure ou recupere a função cardíaca e o fluxo coronariano, evitando a necessidade de submeter os pacientes ao transplante cardíaco; este seria o dispositivo efetivo para a terapia de destino3. A avaliação de sobrevida, função e qualidade de vida por intermédio da terapia de destino foi estabelecida no estudo randomizado e prospectivo Randomized Evaluation of Mechanical Assistance (REMATCH) ao comparar os pacientes entre TMO e DAV esquerda (Figura 2)6. No estudo, a mortalidade foi 48% menor no grupo em uso de DAV esquerda quando comparada ao grupo em TMO; todavia, ainda que o implante do dispositivo aponte maior qualidade de vida, não se deve tergiversar quanto aos possíveis efeitos adversos, como acidente vascular encefálico, infecção, hemorragia e falha do dispositivo6.
A ponte para decisão (PPD), refere-se à efetividade ainda desconhecida da assistência circulatória mecânica na reversão de situações de contraindicação relativa ao transplante cardíaco, não sendo, portanto, reconhecida pela Food and Drug Administration (FDA) como indicação aprovada de SCM6.
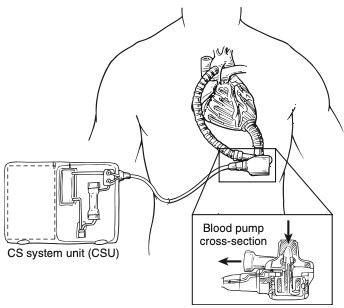
Figura 2. EVAHEART, um dispositivo de assistência ventricular esquerda.
Fonte: Kouchoukos NT et al.7.
O primeiro implante de ventrículo artificial foi realizado por Liotta em 1963, constituído por tubo valvado e um compressor pneumático conectando ao átrio esquerdo e à aorta descendente3. O primeiro implante de coração artificial total (CAT) se deu em 1969, realizado por Denton Cooley por meio do dispositivo denominado “Liotta-Cooley” (Figura 3), com o intuito de PPT9. Contudo, neste último caso, a alta mortalidade e as falhas súbitas desviaram a atenção, anteriormente voltada ao CAT, para as bombas de suporte univentricular, DAVs3. Iniciava-se a primeira geração dos dispositivos, com progressiva evolução para a terceira geração atual (Figura 4).
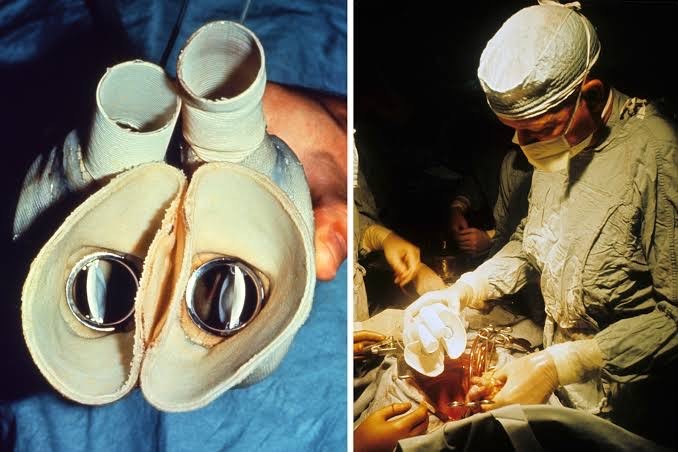
Figura 3. Coração Artificial Total de Liotta-Cooley sendo implantado em 4 de abril de 1969. À esquerda, o dispositivo e, à direita, Denton Cooley prestes a implantá-lo no mediastino pós-cardiectomia.
Fonte: Texasheart.org.10.
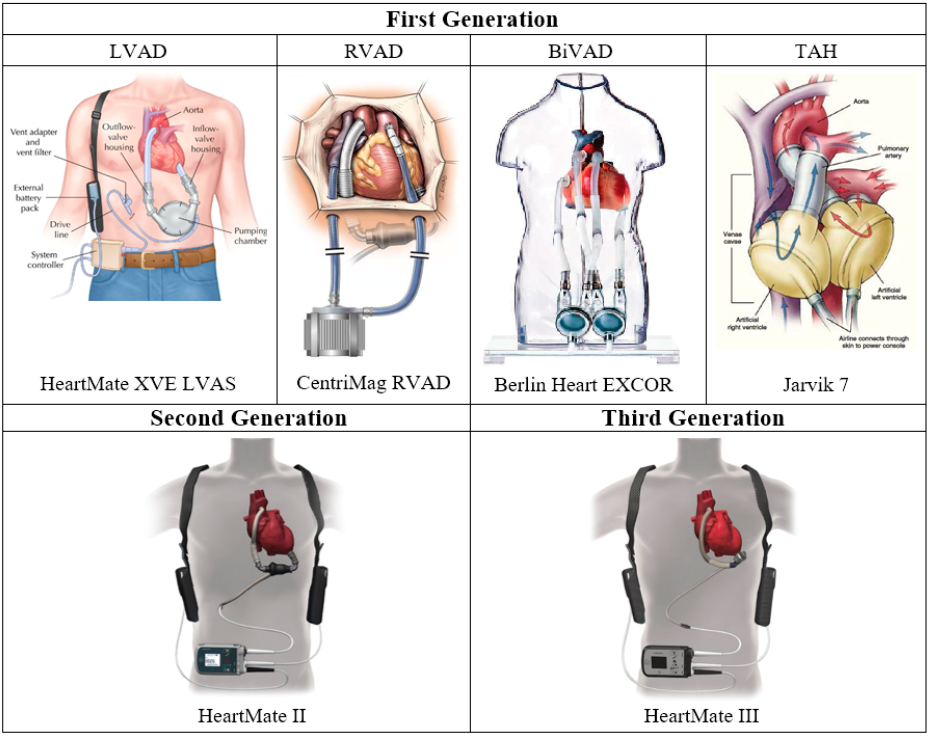
Figura 4. Gerações de SCM.
Fonte: Han e Trumble3.
A primeira geração de DAVs foi concebida como bombas pulsáteis (Figura 5A), projetadas para reproduzir o ciclo cardíaco do paciente e promover fluxo pulsátil através de um diafragma e valvas cardíacas artificiais unidirecionais, sendo marcante a característica de seu grande tamanho e massa, além da unidade motriz externa que limitava a mobilidade dos pacientes3. Eram empregados para suportar os pacientes até o transplante podendo-se citar DAVs como HeartMate XVE da Thoratec, dos Estados Unidos e Berlin Heart EXCOR, da Berlin Heart, da Alemanha. As bombas pulsáteis podem ser usadas como assistência ventricular esquerda (DAVE), direita (DAVD) ou biventricular (DABiV)3.
Nos casos de DAVEs, a direção do fluxo se dá do ápice do coração até a aorta ascendente e assim se restabelece o fluxo para a periferia, esvazia-se o ventrículo esquerdo e pode-se prevenir o remodelamento do ventrículo esquerdo ou, se já presente pela sobrecarga pressórica crônica, pode-se provocar remodelamento reverso, sendo o primeiro implante de DAVE realizado por DeBakey em 1966. São DAVEs de primeira geração o Novacor LVAS, da Baxter Healthcare, além do Heart Mate I e do Thoratec PVAD, os dois últimos da Thoratec, todos de origem norte-americana3.
Contudo, DAVEs podem causar efeitos danosos ao ventrículo direito em consequência da redução da pressão pulmonar, levando à sua insuficiência por aumento da pré-carga, desvio do septo para a esquerda e redução da contratilidade do septo interventricular, além do aumento do esforço do VD para equilibrar com o débito do DAVE e de distorções da valva tricúspide, sendo necessário implante de DAVD em 4% dos pacientes3. Os DAVDs, além da situação citada, são usualmente empregados na prática em acometidos por IAM, embolia pulmonar, hipertensão pulmonar, miocardite, choque pós-cardiotomia e para transplante cardíaco. Atualmente os modelos disponíveis disponíveis para tal são: SynCardia, da SynCardia Systems como PPT; Impella RP, da AbioMed; TandemHeart, da Cardiac Assist; e CentriMag RVAD, da Thoratec, como ponte para suporte mecânico3,11.
Como aproximadamente 45% dos pacientes com DAVE passam a exibir de disfunção ventricular direita pós-operatória, justifica-se o uso de DABiV, sobretudo em pacientes com insuficiência cardíaca total, nos quais suportará ambos os lados da circulação e, raramente, poderá vir a promover a recuperação do miocárdio3. Os dispositivos disponíveis são: AbioMed BSV5000, da AbioMed; Berlin Heart EXCOR, da Berlin Heart; e o alemão Medos HIA-VAD3.
Já a segunda geração de DAVs trouxe grande evolução com o mecanismo de bomba axial não valvulada e campo magnético variável desenvolvido para girar um rotor que cria fluxo axial contínuo paralelo ao eixo de rotação (Figura 5B), além do benefício da redução da massa, uma vez que o HeartMate II, da Thoratec, produzido em 2001, pesava a metade do HeartMate XVE e foi aprovado pela FDA em 2008 como ponte para transplante e em 2010 como terapia de destino3,4. Outros modelos foram Hemopump, da Medtronic, DeBakey VAD, da Micromed, HeartAssist-5, da Reliant Heart, Jarvik 2000, da Jarvik Heart, Impella, da Abiomed e Incor, da Berlin Heart3,4. Indubitavelmente, a segunda geração proporcionou melhora da qualidade de vida, mobilidade e restabelecimento da função cardíaca, quando comparada à primeira geração, entretanto ainda utilizava fonte de energia extracorpórea e necessitava de anticoagulação dos portadores enquanto durasse o implante, a fim de evitar tromboembolismo3.
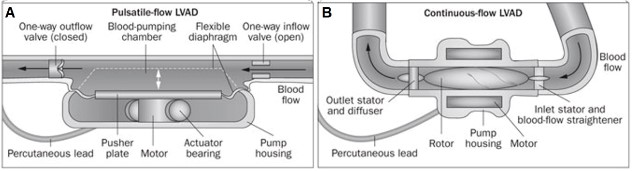
Figura 5. (A) Primeira geração com bomba de fluxo pulsátil, mimetizando o ciclo cardíaco por meio de diafragma e valva unidirecional. (B) Segunda geração com bomba de fluxo contínuo axial, sem valva, valendo-se de propulsor com rotações.
Fonte: Han e Trumble3.
A terceira geração reduziu ainda mais o tamanho dos dispositivos e consiste em bomba de fluxo centrífugo contínuo perpendicular ao eixo de rotação, livre de contato e sem rolamentos com rotor suspenso que utiliza sistema magnético e/ou hidrodinâmico, evitando assim a formação de trombos e seu deslocamento, além de redução sonora e de infecções3,4. O sistema de levitação hidrodinâmica, livre de contato, utiliza uma camada de sangue como suporte para levantar o rotor, a exemplo dos dispositivos Incor, HVAD e MVAD, enquanto a levitação magnética completa usa rolamentos magnéticos apenas para levitar o rotor, caso do HeartMate III4.
Os DAVs convencionais de fluxo contínuo foram desenvolvidos especificamente para adultos, visto que compõem a maioria dos acometidos por IC em estágio terminal, sendo, portanto, muito grandes para a população pediátrica com massa menor que 25 kg3. Para pacientes pediátricos, estão disponíveis os modelos Berlin Heart EXCOR Pediatric, Jarvik 2000 para crianças e bebês, PediFlow para bebês e crianças com peso entre 2 e 25 kg, o MVAD HeartWare em miniatura, da HeartWare e o CircuLite, da CircuLite Inc3.
No cenário de Coração Artificial Total, o objetivo é substituir completamente a função do coração nativo por período prolongado no tratamento de IC em estágio final e desde o pioneirismo de Denton Cooley com o Liotta-Cooley, foram desenvolvidos e vêm sendo utilizados o CardioWest, da SynCardia (Figura 6) e o Abiocor, da AbioMed (Figura 7)3.
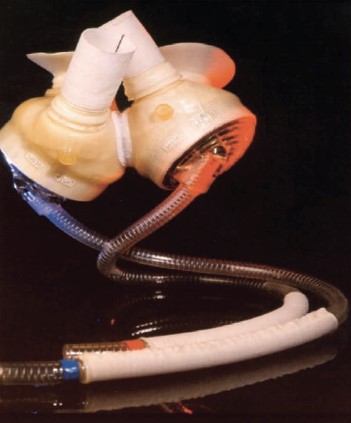
Figura 6. CAT SynCardia.
Fonte: Kouchoukos et al.7.

Figura 7. CAT Abiocor.
Fonte: Kouchoukos et al.7.
Apesar dos avanços, ainda existem inúmeros desafios, complicações podem ocorrer como arritmias ventriculares, IC direita, infecção percutânea da linha de transmissão (Figura 8A), trombose da bomba (Figura 8B) e sangramento gastrointestinal (Figura 8C), além dos cuidados necessários e de problemas no manejo de pacientes de longo prazo, sem contar as diretrizes ainda em evolução no que diz respeito aos critérios de elegibilidade para implante e terapia com DAV3. Vale ressaltar que o valor da terapia é alto, atingindo centenas de milhares de dólares com os dispositivos de assistência ventricular.
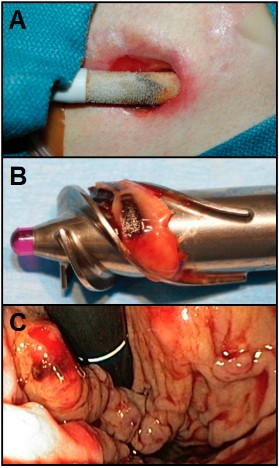
Figura 8. (A) Infecção percutânea da linha de transmissão com sinais flogísticos evidentes. (B) trombose da bomba, podendo cursar com embolismo. (C) Sangramento gastrointestinal visualizado a partir de endoscopia digestiva alta.
Fonte: Han e Trumble3.
No campo do suporte circulatório de curto prazo como exemplo de maior popularidade, pode-se citar a ECMO (Figura 9A), uma forma de circulação extracorpórea utilizada como PPR, PPT ou suporte circulatório mecânico ao oxigenar o sangue e fazê-lo circular através de bombas mecânicas fora do corpo, com duração de horas a dias e até semanas, seu uso prolongado ainda é limitado pois aumenta o risco de complicações trombóticas3,11.
Outro exemplo é o Impella (Figura 9B), uma bomba sanguínea microaxial intravascular que oferece suporte circulatório parcial de horas até um mês, com modelos específicos para cada ventrículo, bem como para o fluxo desejado, e que conta com um controlador automatizado que monitora e controla todo o sistema3.
Já o balão intra-aórtico (BIA) (Figura 9C) é uma bomba pneumática de contrapulsação aplicada em pacientes com IC, tendo funcionamento baseado na insuflação durante a diástole ventricular, aumentando a pressão diastólica, o fluxo coronariano e a perfusão sistêmica, ao passo que desinfla rapidamente durante a sístole para reduzir a pós-carga e elevar o débito cardíaco3.
Além destes, o CentriMag (Figura 9D) da Thoratec é um suporte circulatório sistêmico que pode ser aplicado aos ventrículos individualmente ou em ambos, por intermédio de uma bomba de fluxo contínuo centrífugo sem rolamentos que atinge até 5.500 rotações por minuto e oferta até 9,9 litros por minuto de sangue com duração recomendada de até 6 horas, valendo-se de uma bomba impulsora magneticamente levitada que atua sem contato com o meio, minimizando complicações trombóticas, além da vantagem de poder ser utilizada em necessidade de transporte aéreo, possuindo bateria com carga para 5 horas e possibilidade de alimentação por corrente alternada (AC)3.
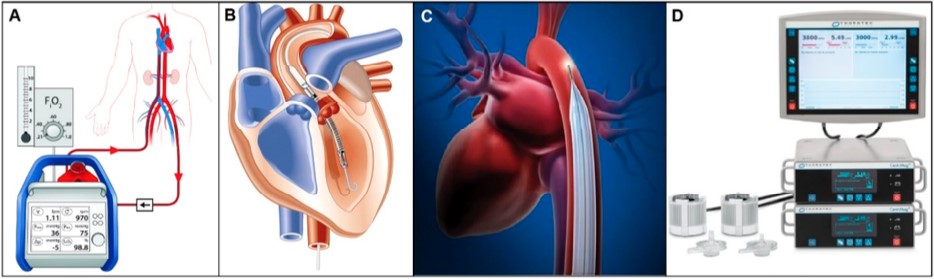
Figura 9. (A) ECMO. (B) Impella. (C) BIA. (D) CentriMag.
Fonte: Han e Trumble3.
A tecnologia de transmissão de energia transcutânea (TET) (Figura 10A) se dá pela transferência de energia através de pele íntegra, anulando os riscos de infecção por ser um sistema de indução eletromagnética pelo acoplamento de duas bobinas (Figura 10B) com adesivo na superfície da implantada externamente, podendo ser retirada por até 30 minutos para que o paciente possa tomar banho3. Contudo, esse dispositivo esbarra no sistema pouco eficiente de energia (80% dela é dissipada) e suas desvantagens tecnológicas (falha fatal de componente, sangramento e dor pelo grande acúmulo de volume das partes implantadas) advogam contra sua indicação rotineira atualmente3.
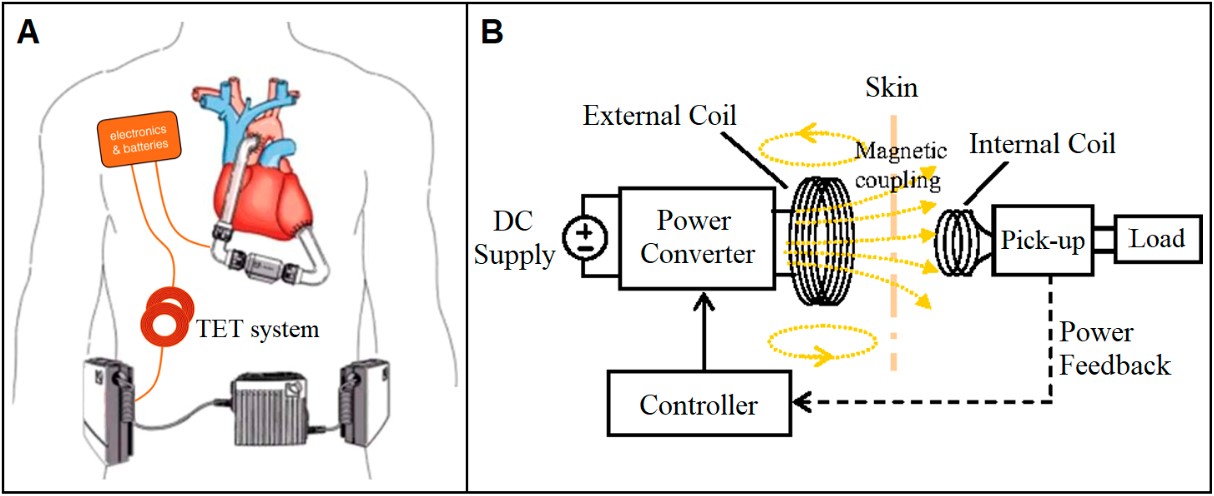
Figura 10. (A) DAV por tecnologia de TET implantado. (B) Como funciona a transmissão de energia.
Fonte: Han e Trumble3.
Há ainda a opção de DAV estimulado eletricamente por músculo esquelético através de um conversor de energia muscular, que, como o próprio nome sugere, converte a energia endógena do músculo em força hidráulica. Normalmente utilizando o músculo latíssimo do dorso, por seu tamanho e proximidade com a cavidade torácica (Figura 11), o próprio corpo fornece energia para auxiliar o coração insuficiente por longo período, constituindo estratégia promissora3. A sincronização da atividade muscular com o ciclo cardíaco se dá através de cardiomioestimulador programável, similar a um marca-passo, que demonstrou produzir potência mecânica suficiente para a atividade pulsátil do dispositivo3.
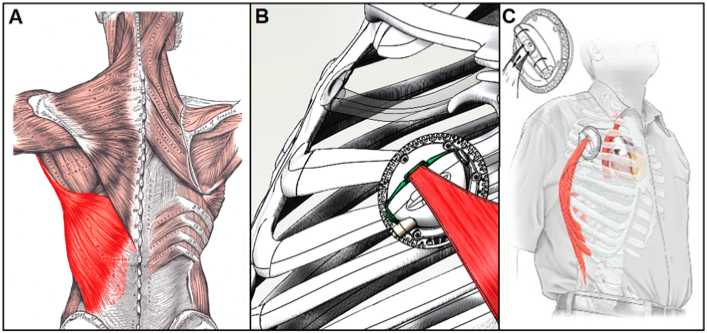
Figura 11. (A) Músculo latíssimo do dorso em realce. (B) Conversor de energia muscular. (C) Proximidade da localização do implante com o dispositivo na cavidade torácica.
Fonte: Han e Trumble3.
Outra opção se dá por meio de contrapulsação cardíaca direta através de uma manga compressiva que aplica pressão diretamente na superfície cardíaca, isto é, sobre o epicárdio, coordenada com a contração ventricular natural para impulsionar a fração de ejeção, podendo ser artificial, com manga de silicone (Figura 12A) agindo como músculos pneumáticos dispostos helicoidal e circunferencialmente tanto para comprimir quanto para torcer o coração, sem haver qualquer contato com o sangue3. Em testes com porcos, esta forma restabeleceu o débito cardíaco em 88% comparado ao normal3. Outras variantes incluem o emprego minimamente invasivo com implante de dispositivo que envolve os ventrículos com uma câmara pneumática customizada (Figura 12B), que mostrou aumento de até 50% no débito cardíaco de animais de grande porte com IC aguda, além do dispositivo geométrico com tubos de parede fina, alimentados por energia muscular e cuja manga comprime hidraulicamente (Figura 12C), ainda em desenvolvimento3. Ademais, o dispositivo de balão intra-aórtico externo (BIAE) comprime a superfície externa da aorta ascendente (Figura 12D) com contrapulsação e aumenta a pressão diastólica, o débito cardíaco e os fluxos regional e coronariano sem contato com a corrente sanguínea3.
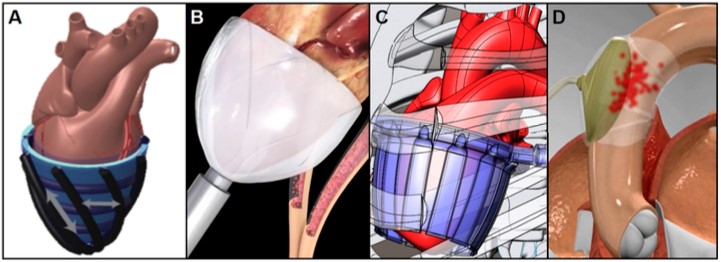
Figura 12. (A) Manga de silicone. (B) Manga pneumática. (C) Manga hidráulica geométrica alimentada por energia muscular. (D) BIAE.
Fonte: Han e Trumble3.
Em conclusão, percebe-se a gama de dispositivos disponíveis em desenvolvimento, sendo alguns mais populares que os outros. O fato é que o transplante cardíaco permanece como o tratamento de escolha para os pacientes com IC descompensada, entretanto dispositivos podem ser utilizados para que os pacientes possam esperar o coração doado com alívio dos sintomas e, em alguns casos, recuperar a função cardíaca. Outrossim, vale ressaltar que já existe a opção do emprego em longo prazo de dispositivos de assistência circulatória caso o paciente possua contraindicação ao transplante. Torna-se claro que devemos incentivar a indústria nacional no desenvolvimento e na criação de tais dispositivos com o objetivo de prover equipamentos com menor custo, maior durabilidade e menores complicações que as atuais opções vigentes. Por fim, vale ressaltar que campanhas contínuas de doação de órgãos continuam sendo vitais para promover maior oferta de corações e redução da cruel fila de espera.
Referências
1. Liguori GR, Barros LN, Tenório DF, Jatene FB, Almeida RMS. Manual Acadêmico de Cirurgia Cardiovascular – SBCCV/DBLACV. São Paulo: Atheneu; 2014. p. 225.
2. Kubrusly LF. Ventricular assist devices: an evolving field. Braz J Cardiovasc Surg. 2019;34(1).
3. Han J, Trumble DR. Cardiac assist devices: early concepts, current technologies, and future innovations. Bioengineering. 2019;6(1):18.
4. Mancini D, Colombo PC. Left ventricular assist devices a rapidly evolving alternative to transplant. J Am Coll Cardiol. 2015;65(23)2542-2555.
5. Sociedade Brasileira de Cardiologia. Diretriz Brasileira de Insuficiência Cardíaca Crônica e Aguda. Arq. Bras. Cardiol. São Paulo, v. 111, n. 3, p. 436-539, Sept. 2018. Disponível em: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0066- 782X2018001500436&lng=en&nrm=iso>.
6. Mann D, Zipes DP, Libby P, Bonow RO. Braunwald – Tratado de doenças cardiovasculares. 10. ed. Rio de Janeiro: Elsevier; 2017.
7. Kouchoukos NT, Blackstone EH, Hanley FL, Kirklin JK, eds. Kirklin/Barratt-Boyes cardiac surgery. 4th ed. Philadelphia: Elsevier Saunders; 2012.
8. Marin-Neto JA. Miocárdio hibernante: uma realidade clínica. Rev Assoc Med Bras. 1997;43(4):343-346.
9. Cohn WE, Timms DL, Frazler OH. Total artificial hearts: past, present and future. Nat Rev Cardiol. 2015;12, 609-617.
10. Texas Heart Institute. 50th Anniversary of the World’s First Total Artificial Heart. 2019. [acesso em: 2020 jul. 16]. Disponível em: https://www.texasheart.org/the-institute/50th-anniversary-of-the-worlds-first-total-artificial-heart/
11. Ayub-Ferreira SM, Souza Neto JD, Almeida DR, Biselli B, Avila MS, Colafranceschi AS et al. Diretriz de Assistência Circulatória Mecânica da Sociedade Brasileira de Cardiologia. Arq. Bras. Cardiol. [Internet]. 2016 Aug [cited 2020 July 17]; 107(2 Suppl 2):1-33. Available from: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0066-782X2016004700001&lng=en. https://doi.org/10.5935/abc.20160128.