A fibrilação atrial (FA) é a taquiarritmia crônica mais comum na prática médica. Diante de um paciente com FA, o tratamento inicial divide-se entre duas opções terapêuticas: controle do ritmo cardíaco ou reversão do ritmo fibrilatório. Entretanto, se tais estratégias não atingirem as metas preestabelecidas, ou se os sintomas persistirem, a FA é considerada refratária. Na FA refratária, abordagens intervencionistas devem ser consideradas, como a ablação por radiofrequência dos focos extrassistólicos próximos às veias pulmonares (gatilhos para FA), ou ainda, a ablação do nódulo atrioventricular, seguida de implante de marcapasso definitivo.1
Estas abordagens, realizadas via cateter, constituem, na realidade, adaptações das técnicas cirúrgicas para o tratamento da FA. Existem diversas técnicas cirúrgicas para prevenir recidivas da FA, a maioria atingindo altas taxas de sucesso (> 90%)2 em curto e longo prazo. O ensaio clínico “Atrial Fibrillation Catheter Ablation Versus Surgical Ablation Treatment” (FAST), ao comparar a intervenção via cateter à cirurgia minimamente invasiva, demonstrou que em pacientes com dilatação do átrio esquerdo, hipertensão ou falha de ablação anterior via cateter, a abordagem cirúrgica foi superior quanto à recorrência de arritmias atriais esquerdas após 12 meses de acompanhamento. Contudo, a taxa de eventos adversos do procedimento foi significativamente superior na abordagem cirúrgica.3
Assim, hoje, a ablação cirúrgica é indicada para pacientes que apresentaram recidiva após ablação por cateter, ou pacientes com outras indicações de cirurgia cardiovascular (correção de valvopatia ou coronariopatia). Dentre as abordagens cirúrgicas para FA, a cirurgia de Cox-Maze é uma das mais bem aceitas.
A cirurgia Maze
A cirurgia de Cox-Maze, desenvolvida por James Cox, consiste na realização de diversas incisões (lesões) em ambos os átrios, isolando regiões do miocárdio atrial e, portanto, impedindo a propagação das ondas de reentrada (Figura 1). O objetivo é fazer com que o estímulo sinusal chegue ao nódulo atrioventricular sem a interferência de estímulos originados nos átrios. O termo “maze” (labirinto em português) foi atribuído ao procedimento devido à estratégia de criar lesões que bloqueiam a condução do estímulo elétrico em um padrão semelhante ao de um labirinto. Após a cirurgia, todo o tecido atrial (exceto os apêndices atriais e as veias pulmonares) é eletricamente ativado, fornecendo vários “becos sem saída” entre o nó sinoatrial e o nó atrioventricular.4 Os principais inconvenientes da cirurgia são: (1) necessidade de marcapasso definitivo em 40% dos casos, por disfunção do nódulo sinoatrial; e (2) disfunção do miocárdio atrial.5
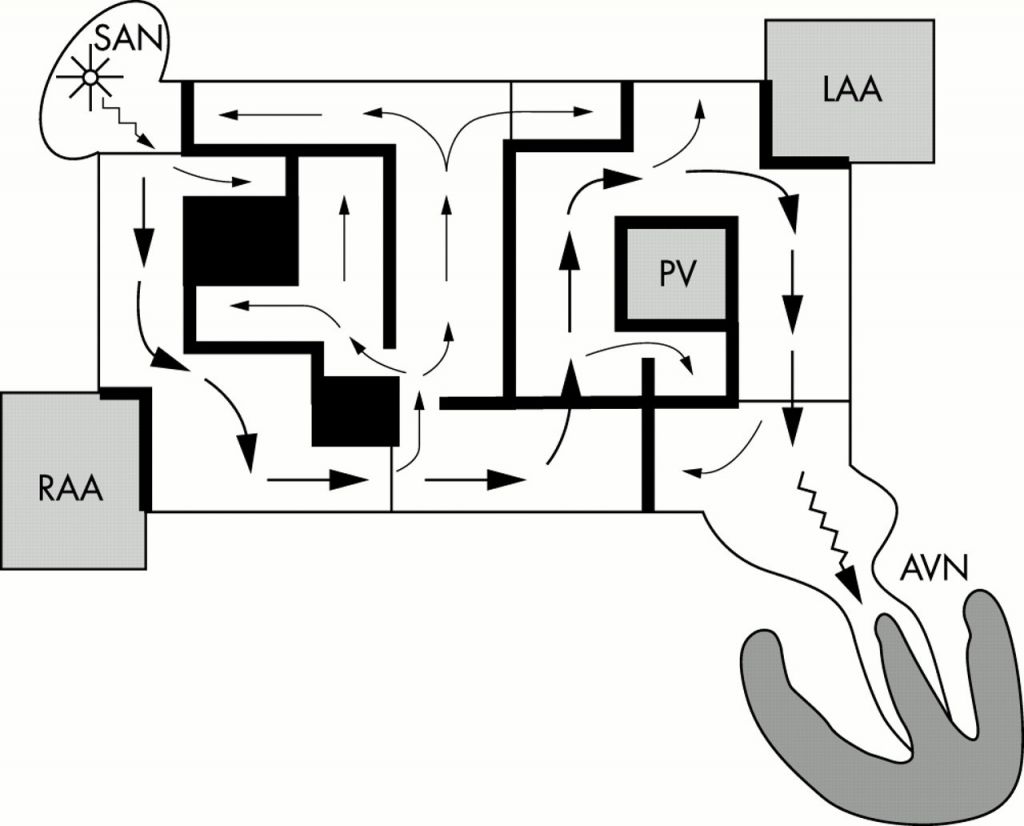
A construção da cirurgia de Cox-Maze
A partir do conceito de criação de um padrão de labirinto nos átrios, a cirurgia de Cox-Maze passou por uma série de aperfeiçoamentos, introduzindo novas formas de realização do procedimento (Figura 2).
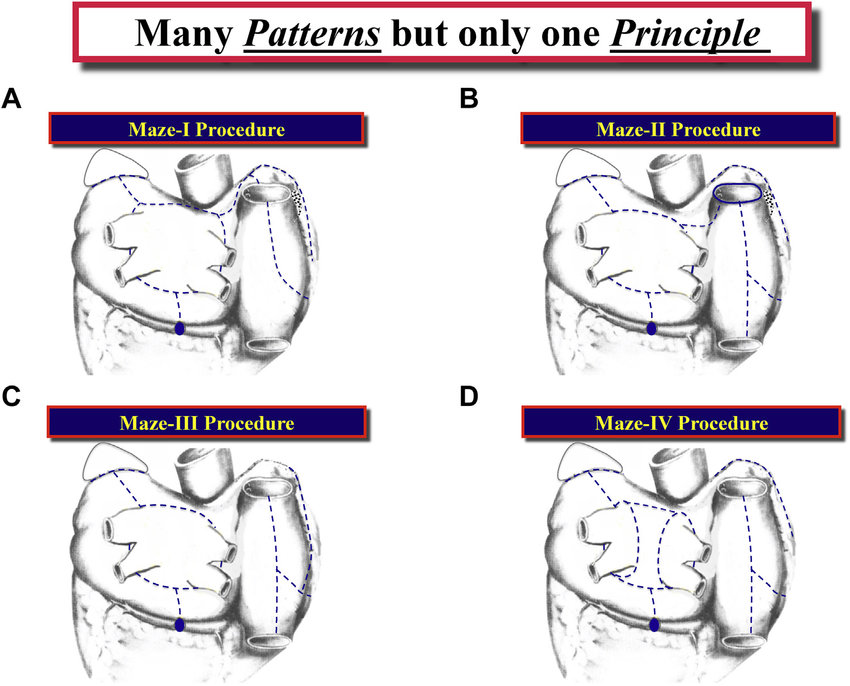
Figura 2. Ilustração dos padrões de lesões nos procedimentos Cox-Maze I, II, III e IV. Fonte: Cox et al, 2018.4
Maze-I
A técnica inicial da cirurgia de Cox-Maze (Maze-I), descrita em 1987, foi capaz de eliminar o ritmo de FA, restabelecendo um ritmo sinusal. Contudo, o procedimento implicava em lesar a área do marcapasso atrial responsável por modular a resposta cronotrópica durante o exercício e o feixe de Bachmann, responsável pela despolarização quase simultânea dos átrios direito e esquerdo. Como resultado, alguns pacientes operados passaram a apresentar uma resposta cronotrópica inapropriada e um atraso da condução intra-atrial no pós-operatório.4
Maze-II
Diante das desvantagens da cirurgia de Cox-Maze-I, as lesões antes realizadas nas regiões anterossuperiores dos átrios direito e esquerdo, foram substituídas por um padrão de lesões em regiões mais posteriores dos átrios, conhecido como Maze-II. Contudo, visando exposição ideal do átrio esquerdo, a técnica apresentava maior complexidade, exigindo a transecção completa da veia cava superior acima do átrio direito, e acabou sendo precocemente abandonada.4
Maze-III
Além de manter um padrão de lesões concentrado nas regiões posteriores dos átrios, a cirurgia de Cox-Maze -III, realizada pela primeira vez em 1992, incluiu a realização de uma lesão no septo interatrial de forma a suprir a necessidade de uma exposição operatória adequada. Com o advento das técnicas minimamente invasivas, a cirurgia de Cox-Maze -III passou a ser realizada através de uma minitoracotomia ântero-lateral direita, e a lesão septal foi abandonada. Diante da superioridade desta abordagem em comparação à Maze-I e Maze-II, a cirurgia de Cox-Maze -III tornou-se a base para as adaptações que se sucederam. Em 1997, o procedimento foi adaptado para a realização de lesões criocirúrgicas, apresentando a mesma taxa de sucesso da cirurgia de Cox-Maze -III original, porém, com menor ocorrência de complicações.4
Maze-IV
Em 2002, um novo padrão que consistia na criação de lesões usando uma combinação de radiofrequência bipolar pinças e criossondas lineares foi elaborado (Maze-IV). As lesões do procedimento de Cox-Maze -IV são eletrofisiologicamente idênticas àquelas do procedimento Maze-III. No entanto, o procedimento Maze-IV pode ser realizado mais rapidamente, produzindo os mesmos resultados que o procedimento Maze-III, com menor morbidade pós-operatória.
Assim, o procedimento Maze-IV representa, atualmente, o tratamento cirúrgico padrão-ouro para FA, resultando em 93% dos pacientes livres de FA e 85% livres de FA e de drogas antiarrítmicas no acompanhamento durante 1 ano. Além disso, o procedimento não incrementa a morbidade ou mortalidade em cirurgias de plastia da valva mitral, troca de valva aórtica ou cirurgia de revascularização do miocárdio.4
Referências
- Wijesurendra RS, Casadei B. Mechanisms of atrial fibrillation. Heart. 2019 Dec;105(24):1860-1867. doi: 10.1136/heartjnl-2018-314267. Epub 2019 Aug 23. PMID: 31444267.
- Alreshidan M, Roberts HG, Rankin JS, Wei LM, Badhwar V. Current Approach to Surgical Ablation for Atrial Fibrillation. Semin Thorac Cardiovasc Surg. 2019 Summer;31(2):141-145. doi: 10.1053/j.semtcvs.2019.02.026. Epub 2019 Feb 27. PMID: 30825589.
- Boersma LV, Castella M, van Boven W, Berruezo A, Yilmaz A, Nadal M, Sandoval E, Calvo N, Brugada J, Kelder J, Wijffels M, Mont L. Atrial fibrillation catheter ablation versus surgical ablation treatment (FAST): a 2-center randomized clinical trial. Circulation. 2012 Jan 3;125(1):23-30. doi: 10.1161/CIRCULATIONAHA.111.074047. Epub 2011 Nov 14. PMID: 22082673.
- Cox JL, Churyla A, Malaisrie SC, Kruse J, Pham DT, Kislitsina ON, McCarthy PM. When Is a Maze Procedure a Maze Procedure? Can J Cardiol. 2018 Nov;34(11):1482-1491. doi: 10.1016/j.cjca.2018.05.008. Epub 2018 Jun 20. PMID: 30121148.
- Cox JL, Ad N, Churyla A, Malaisrie SC, Pham DT, Kruse J, Kislitsina ON, McCarthy PM. The Maze Procedure and Postoperative Pacemakers. Ann Thorac Surg. 2018 Nov;106(5):1561-1569. doi: 10.1016/j.athoracsur.2018.05.013. Epub 2018 Jun 5. PMID: 29883654.
- Lairikyengbam SKS, Anderson MH, Davies AG. Present treatment options for atrial fibrillationPostgraduate Medical Journal 2003;79:67-73.
- Henn MC, Lancaster TS, Miller JR, Sinn LA, Schuessler RB, Moon MR, Melby SJ, Maniar HS, Damiano RJ Jr. Late outcomes after the Cox maze IV procedure for atrial fibrillation. J Thorac Cardiovasc Surg. 2015 Nov;150(5):1168-76, 1178.e1-2. doi: 10.1016/j.jtcvs.2015.07.102. Epub 2015 Aug 8. PMID: 26432719; PMCID: PMC4637220.