Truncus arteriosus (TA) é definido como uma malformação cardiovascular congênita em que uma grande artéria surge da base do coração e dá origem às artérias coronárias, artérias pulmonares e sistêmicas1(Figura 1), representando 1,5% dos casos de cardiopatias congênitas em neonatos2. O reparo precoce é indicado para corrigir o hiperfluxo pulmonar que pode levar a doença vascular pulmonar grave, insuficiência cardíaca (IC) e a morte3.
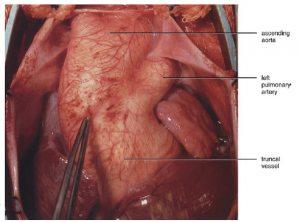
Figura 1. Truncus arteriosus. Fonte: Litwin4
A classificação do TA já passou por revisões significativas, devido ao reconhecimento de diferentes origens das artérias pulmonares, da interrupção do arco aórtico e dos tamanhos relativos da aorta e troncos pulmonares5.
O sistema proposto por Collett e Edwards, é baseado em uma descrição da origem das artérias pulmonares. O tipo 1 significa um segmento discreto da artéria pulmonar principal, que então se bifurca em uma artéria pulmonar esquerda e direita. No TA tipo 2, as artérias pulmonares esquerda e direita surgem como orifícios adjacentes separados da região posterior do truncus. No tipo 3, as artérias pulmonares esquerda e direita surgem como orifícios distantes separados de lados opostos do truncus. O tipo 4 não é mais considerado relacionado ao tronco arterial comum e faz parte do espectro da atresia pulmonar com comunicação interventricular e colaterais aortopulmonares6.
Já segundo a classificação de Van Praagh existem dois tipos básicos de TA: tipo A, aqueles com defeito do septo ventricular (VSD), relativamente frequente; e tipo B, aqueles sem VSD (raro). Ambos os tipos também são classificados em termos de cavidades: tipo 1 – o septo aorticopulmonar (AP) é parcialmente formado, resultando em um septo parcialmente separando a artéria pulmonar principal; tipo 2 – o septo AP está totalmente ausente, com ambos os ramos arteriais pulmonares surgindo diretamente do tronco comum; tipo 3 – ausência de um ramo arterial pulmonar e o pulmão sendo, portanto, abastecido por vasos colaterais; e tipo 4, o istmo aórtico exibe hipoplasia, coarctação, atresia ou ausência, associada a grande persistência do canal arterial. Os tipos 1 a 3 exibem um quarto arco bem desenvolvido e um sexto arco mal desenvolvido; já o tipo 4 tem um quarto arco mal desenvolvido e um sexto bem desenvolvido (hipoplasia, coarctação, atresia ou ausência do istmo aórtico e um grande persistência do canal arterial) 7 (Figura 2).
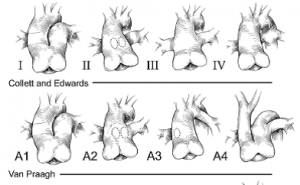
Figura 2. Semelhanças entre as classificações de Collett e Edwards, Van Praagh. Fonte: Mavroudis5
Uma nova e simplificada classificação anatômica de TA, mais recente, apresenta uma categorização mais generalizada com base na dominância do tronco aórtico ou pulmonar. Esta classificação recente vê essa cardiopatia como um tronco arterial comum associado a qualquer característica da artéria pulmonar (Fig. 3a) ou características aórtica (Fig.3b)5.
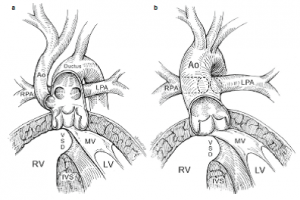
Figura 3. Classificação mais recente e generalizada do truncus arteriosus. Fonte: Mavroudis5
O reparo do TA persistente é a baseado no estabelecimento de uma nova continuidade entre o ventrículo direito (VD) e a artéria pulmonar (AP). A correção cirúrgica consiste na separação do tronco pulmonar ou artérias pulmonares (AP) do TA, fechamento da comunicação interventricular (CIV) e reconstrução do ventrículo direito (VD) – continuidade do AP. A reconstrução da via de saída do ventrículo direito (VSVD) geralmente é realizada com o uso de um conduto protético8 (Figura 4).
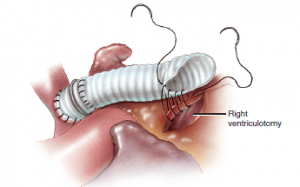
Figura 4. A extremidade proximal do conduto composto é encurtada e chanfrado para aproximação da ventriculotomia direita. Fonte: Doty9
Embora o reparo por conduto seja caro e limitado pelo tamanho disponível, ele apresenta diversas vantagens no reparo cirúrgico do TA persistente, incluindo possibilitar uma cirurgia rápida e simples e garantida competência da válvula pulmonar10. No entanto, quando um conduto valvulado é usado em bebês e crianças pequenas, a substituição irá sempre ser necessária, devido à falha do conduto ou crescimento do paciente, resultando em um conduto de tamanho inadequado4. A reconstrução VD – AP sem o uso de um conduto pode superar os problemas no reparo cirúrgico do TA persistente, permitindo um crescimento somático10. Essa última técnica de reparo, consiste numa anastomose direta VD-AP, mobilizando a borda inferior do tronco pulmonar para a ventriculotomia direita, ou criando um retalho de parede do tronco pulmonar que pode ser usado como parede posterior da VSVD quando anastomosado com a ventriculotomia direita. Quando uma anastomose direta não é viável, a interposição do apêndice atrial esquerdo (AAE) como parede posterior pode ser eficaz para reduzir a tensão anastomótica8.
Estudos vem sendo realizados comparando os resultados de ambas técnicas. Recentemente, estudo realizado por Padalino et al.(2020)8, que avaliou os resultados e a viabilidade de diferentes técnicas de reconstrução da VSVD na correção cirúrgica do TA, concluiu que entre os 2 grupos (uso de conduto e não uso), não houve diferenças em termos de mortalidade tardia e início de eventos adversos, embora o uso de um conduto parecia mais sujeito a reintervenção e aparecimento de eventos adversos.
Em suma, apesar dos estudos relacionados ao truncus arteriosus e suas diversas classificações anatômicas, ainda são escassas as pesquisas comparando as diferentes técnicas atualmente utilizadas em sua correção, o que só evidencia que ainda temos muito a aprender e pesquisar sobre TA.
Referências
- Calder L, Van Praagh R, Van Praagh S, Sears WP, Corwin R, Levy A, et al. Truncus arteriosus communis: clinical, angiocardiographic, and pathologic findings in 100 patients. Am Heart J. 1976; 92 (1): 23-38.
- Lopes ML, Silva JP, Fonseca L, Meiken S, Salvador ABC, Fernandes GSS. Atypical Truncus Arteriosus Operated at 28 Years of Age: Importance of Differential Diagnosis. Arq Bras Cardiol 2011; 97(2) : e29-e32
- Hanley FL, Heinemann MK, Jonas RA, Mayer JJr, Cook NR, Wessel DL et al. Reparo do truncus arteriosus no neonato. J Thorac Cardiovasc Surg 1993;105: 1047-56.
- Litwin, SB. Color Atlas of Congenital Heart Surgery. London: Springer-Verlag; 2007.
- Mavroudis C, Backer CL (eds.). Atlas of pediatric cardiac surgery. London: Springer-Verlag; 2015.
- Chai PJ, Jacobs JP, Quintessenza JA. Surgery for common arterial trunk. Cardiol Young. 2012 Dec;22(6):691-5
- Van Praagh R, Van Praagh S. The anatomy of common aorticopulmonary trunk (truncus arteriosus communis) and its embryologic implications: a study of 57 necropsy cases. Am J Cardiol. 1965; 16 (3): 406-25.
- Padalino MA, C¸elmeta B, Vedovelli L, Castaldi B, Vida VL, Stellin G. Alternative techniques of right ventricular outflow tract reconstruction for surgical repair of truncus arteriosus. Interact CardioVasc Thorac Surg 2020;30:910–6.
- Doty D, Doty J. Cardiac surgery operative technique. ed. Philadelphia: Saunders; 2012.
- Nemoto S, Ozawa H, Sasaki T, Katsumata T, Kishi K, Okumura K, Mori Y. Repair of persistent truncus arteriosus without a conduit: sleeve resection of the pulmonary trunk from the aorta and direct right ventricle-pulmonary artery anastomosis. Eur J Cardiothorac Surg. 2011 Sep;40(3):563-8.