
As lesões isquêmicas da medula espinhal durante o tratamento das doenças da aorta distal, seja no reparo aberto, seja no endovascular, ainda representam uma das complicações mais temidas desses procedimentos. Os principais fatores de risco para isquemia medular no contexto operatório são: apresentação da doença em caráter de emergência (dissecção de aorta ou ruptura aneurismática), tempo de clampeamento aórtico prolongado, aneurismas de grande extensão (tipos I e II de Crawford, como exibido na Figura 1), hipotensão pós-operatória, idade avançada, histórico de reparo de aneurisma de aorta abdominal, aterosclerose grave da parede aórtica, diabetes mellitus e ligação dos vasos espinhais colaterais, como observado na Tabela 11. Apesar de o mecanismo de injúria ainda não ser completamente entendido, ele é geralmente associado com a interrupção do fluxo sanguíneo aórtico distal durante o clampeamento proximal da aorta, bem como a ligadura intraoperatória das artérias lombares e intercostais. Estudos da década de 1990 mostravam uma taxa de paraplegia ou paraparesia de até 30% em algumas coortes 2. Hoje, com a evolução das técnicas de neuroproteção e da própria técnica cirúrgica em si, o índice dessas complicações, em centros especializados em cirurgia da aorta, fica em torno de 1 a 5%3.
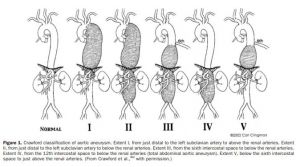
Figura 1. Sistema de classificação de Crawford para aneurismas da aorta toracoabdominal. Fonte: Crawford et al.
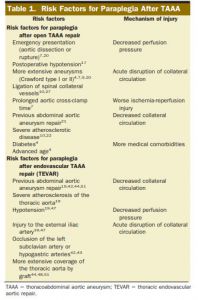
Tabela 1: Fatores de risco para paraplegia em quadro de aneurisma de aorta toracoabdominal. Fonte: Fedorow et al.
Diversas técnicas são empregadas para reduzir o risco de isquemia da medula espinhal inerente ao procedimento, como a perfusão aórtica distal por meio de diferentes técnicas de circulação extracorpórea, monitoramento intraoperatório dos potenciais evocados medulares, reimplante meticuloso dos vasos intercostais e lombares, hipotermia sistêmica permissiva e parada circulatória hipotérmica, além de diversas abordagens farmacológicas 3.
A medula espinhal é suprida pela artéria espinhal anterior, única e longitudinal, e outras duas artérias espinhais, mais plexiformes e posterolaterais, todas com origem nas artérias vertebrais. As artérias anterior e posterior recebem contribuição direta dos ramos radiculares das artérias intercostais, sendo o ramo mais notável a artéria de Adamkiewicz, com origem na porção mais baixa da aorta torácica, geralmente no segmento T8-L1. Entretanto, existem evidências de que o fluxo sanguíneo da medula espinhal não depende unicamente da artéria de Adamkiewicz, e sim de uma rede complexa de colaterais, com contribuições de ramos lombares e pélvicos. Além disso, em pacientes com aterosclerose significativa dos vasos, a circulação colateral desses vasos pode estar comprometida, o que pode aumentar o risco de complicações isquêmicas da medula 1.
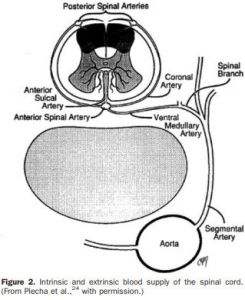
Fig.2: Anatomia vascular da medula espinhal. Fonte: Fedorow et al.
Diversas alterações envolvendo o fluxo sanguíneo aórtico e o líquido cefalorraquidiano (LCR) ocorrem após o clampeamento da aorta. Aumentos na pressão aórtica proximal, na pressão venosa central e no LCR são percebidos com a diminuição concomitante do fluxo sanguíneo distal, que, por sua vez, diminui a pressão de perfusão da medula espinhal (PPME)1. Uma das técnicas mais sabidamente utilizadas na neuroproteção da medula espinhal durante o tratamento de doenças da aorta distal é a drenagem do LCR. Antes do advento desse procedimento, cerca de até 20% dos pacientes submetidos ao reparo aórtico aberto evoluíam com algum prejuízo decorrente da isquemia medular. No tratamento endovascular (TEVAR, do inglês thoracic endovascular aortic repair), não existe a necessidade do clampeamento proximal da aorta. Ainda assim, o risco de lesão isquêmica medular ainda é presente (cerca de 2,5 a 4%), em decorrência do posicionamento do enxerto na aorta, que pode excluir ramos das artérias lombares e intercostais4.
O racional do uso da drenagem do LCR á baseado no aumento da pressão de perfusão da medula espinhal por diminuir a pressão sobre a medula durante o clampeamento aórtico. Além disso, o uso do procedimento é recomendado pelo Colégio Americano de Cardiologia 5 (Figura 3) e pela Sociedade Europeia de Cardiologia 6 em pacientes com alto risco para complicações isquêmicas medulares que se submeterão ao tratamento aberto ou ao endovascular (Figura 4). O “alto risco” depende, além dos fatores já citados, do tipo de stent que será utilizado no reparo endovascular (i.e., os enxertos ramificados apresentam maior risco que os enxertos fenestrados) 7. Além disso, o reparo em dois estágios possui menor risco de complicações medulares isquêmicas quando comparado ao estágio único. Entretanto, o processo de drenagem em si não é isento de complicações. Há relatos de sérias complicações, como lesão de raízes nervosas, hematoma neuroaxial, meningite, hematoma subdural e infarto cerebelar. Complicações menos graves incluem cefaleia pós-punção, paralisia do nervo abducente, infecção localizada e quebra do cateter. As taxas de complicações do dreno do LCR variam em um espectro de até 11%, mas as complicações graves giram em torno de 0,3 a 1% dos casos 8.


Figura 3: Recomendações da ACC/AHA sob a proteção da medula espinhal em procedimentos da aorta distal
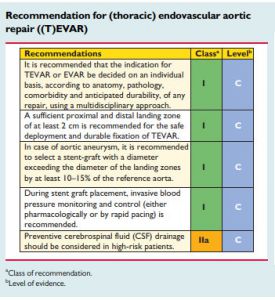
Figura 4: Recomendações da ESC sob a proteção da medula espinhal em procedimentos da aorta distal.
Uma metanálise conduzida pelo grupo da Case Western University 4 buscou avaliar e compilar evidências de estudos que abordavam o uso da drenagem do LCR em pacientes submetidos ao reparo endovascular da aorta. Os autores utilizaram 8 estudos que preencheram os critérios de inclusão. Os protocolos de drenagem do LCR incluíam uma pressão alvo de drenagem entre 8 e 12 mmHg, no intra e pós-operatório. A incidência de eventos isquêmicos medulares variou de 0 a 17% em pacientes que tiveram o LCR drenado e de 0 a 50% em pacientes sem esse procedimento. As complicações da drenagem do LCR variaram de 1 a 28%. Os autores concluíram que pode existir um efeito neuroprotetor da drenagem do liquor na prevenção da isquemia medular, mas os protocolos existentes são muito heterogêneos.
Outro estudo original publicado pelo grupo canadense 7 concluiu que o uso profilático da drenagem liquórica foi associado a risco moderado de complicações, com benefício questionável. O uso de monitoração eletrofisiológica apresentou maior potencial, mas seu uso é limitado por questões logísticas da própria instituição. 8
Nesse sentido, é razoável realizar a drenagem do LCR em pacientes com alto risco cirúrgico para complicações relacionadas à isquemia medular. Apesar disso, todos os estudos recomendam que mais ensaios clínicos randomizados sejam utilizados para que um veredito definitivo possa ser estabelecido.
REFERÊNCIAS
- Fedorow CA, Moon MC, Mutch WAC, Grocott HP. Lumbar cerebrospinal fluid drainage for thoracoabdominal aortic surgery: rationale and practical considerations for management. Anesth Analg. 2010;111(1):46-58. doi: 10.1213/ANE.0b013e3181ddddd6
- Svensson LG, Crawford ES, Hess KR, Coselli JS, Safi HJ. Experience with 1509 patients undergoing thoracoabdominal aortic operations. J Vasc Surg. 1993;17(2):357-370. doi: 10.1016/0741-5214(93)90421-H
- LeMaire SA, Price MD, Green SY, Zarda S, Coselli JS. Results of open thoracoabdominal aortic aneurysm repair. Ann Cardiothorac Surg. 2012;1(3):286-292.
- Malloy PC, Raghavan A, Elder T, Wright J, Wright CH, et al. Cerebrospinal fluid drainage during endovascular aortic aneurysm repair: a systematic review of the literature and treatment recommendations. Vasc Endovasc Surg. 2020;54(3):205-213. doi: 10.1177/1538574419896525
- Hiratzka LF, Bakris GL, Beckman JA, Bersin RM, Carr VF, Casey DE, et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM Guidelines for the Diagnosis and Management of Patients With Thoracic Aortic Disease. J Am Coll Cardiol. 2010;55(14):e27-e129. doi: 10.1016/j.jacc.2010.02.015
- Task A, Erbel R, Germany C, Aboyans V, France C, France CB, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases. Document covering acute and chronic aortic diseases of the thoracic The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). Eur Heart J. 2014;35:2873-2926. doi: 10.1093/eurheartj/ehu281
- Baba T, Ohki T, Kanaoka Y, Maeda K, Ohta H, Fukushima S, et al. Clinical outcomes of spinal cord ischemia after fenestrated and branched endovascular stent grafting during total endovascular aortic repair for thoracoabdominal aortic aneurysms. Ann Vasc Surg. 2017;44:146-157. doi: 10.1016/j.avsg.2017.04.025
- Arora H, Kumar PA. Prophylactic cerebrospinal fluid drainage for high-risk thoracic endovascular aortic repair: safe and effective? J Cardiothorac Vasc Anesth. 2018;32(2):890-892. doi: 10.1053/j.jvca.2018.02.008