Um coração saudável bate mais de 3 bilhões de vezes em uma vida normal, uma sinfonia única e vital comandada pelo marca-passo endógeno, que produz impulsos elétricos rítmicos e espontâneos ao sistema de condução cardíaca. Do maestro, o ritmo se estende por todo o coral que compõe o coração, excitando átrios e ventrículos de uma maneira quase que coreografada.
Um pouco sobre eletrofisiologia
O principal marca-passo endógeno do coração é o nó sinusal, também conhecido como nó sinoatrial (NSA), localizado na junção da veia cava superior com o átrio direito. Os impulsos elétricos se originam no NSA, viajam rapidamente pelos músculos atriais direito e esquerdo, para iniciar a contração atrial e, em seguida, diminuem ao encontrar o nó atrioventricular (AV). O atraso do nó AV permite que os átrios contraiam e preparem os ventrículos com sangue para sua contração subsequente. O nó AV também é um marca-passo secundário que pode servir como suplência (embora em uma frequência muito mais lenta) no caso de falha do NSA primário. Após o nó AV, o impulso elétrico prossegue ao longo do feixe de His, a única conexão elétrica entre os átrios e os ventrículos, e então se espalha rapidamente pelos ventrículos por meio de uma rede de fibras de Purkinje especializadas, que fazem contato com os cardiomiócitos ativos.¹
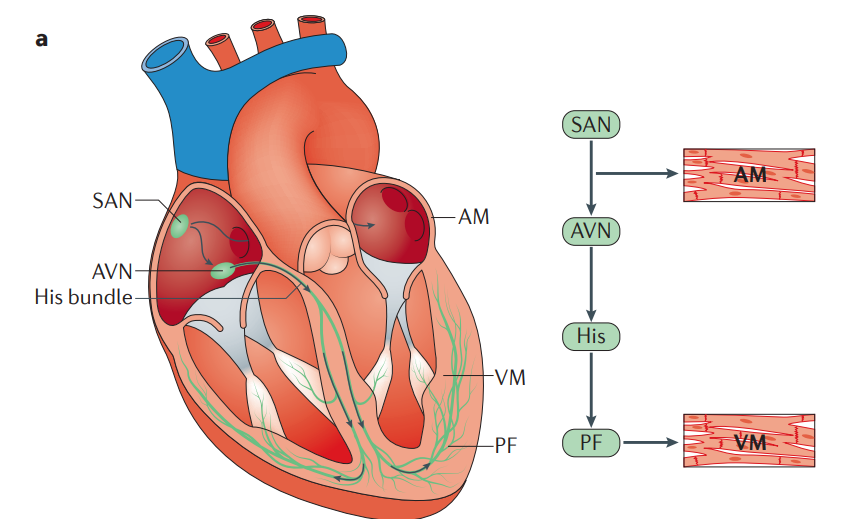
Figura 1: Representação esquemática da anatomia e eletrofisiologia celular do sistema de condução cardíaca. O impulso cardíaco tem origem no nó sinoatrial (SAN), viaja através do miocárdio atrial (AM) e atravessa o nó atrioventricular (AVN), o feixe de His e seus ramos esquerdo e direito. A ativação simultânea de ambos os ramos do feixe e das fibras de Purkinje terminais (PF) fornece ativação anterógrada do miocárdio ventricular (VM), de forma sincronizada.¹
As células do NSA têm osciladores duplos para fornecer despolarização diastólica rítmica e estável, bem como desencadear potenciais de ação do marca-passo. Nessa máquina perfeita, a estimulação adrenérgica e muscarínica do sistema nervoso autônomo auxiliam na coordenação do ritmo e, embora outras partes do sistema de condução, como o nó AV, possam disparar espontaneamente, isso ocorre em uma frequencia mais lenta e geralmente insuficiente para manter débito cardíaco. Portanto, o NSA define a frequência cardíaca substituindo os marca-passos mais lentos abaixo dela. Se a estimulação espontânea abaixo do NSA fosse mais rápida, esses marca-passos ectópicos competiriam com o principal e poderiam causar arritmias.¹
Seguindo essa linha de raciocínio, existem certas doenças cardíacas, especialmente as arritmogênicas, nas quais percebe-se falhas no marca-passo natural do coração. Assim, surge a necessidade de um pequeno dispositivo eletrônico capaz de mimetizar a função do NSA e que é a base da terapia de doenças do sistema de condução cardíaca: o marca-passo artificial.
Breve histórico
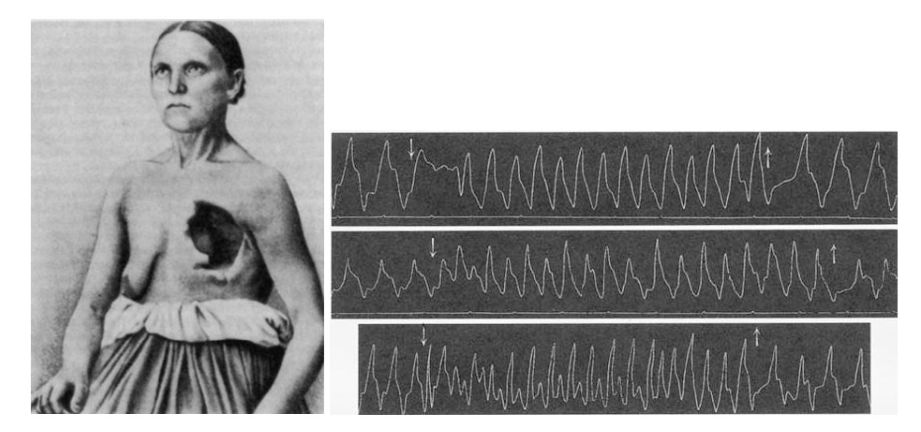
Historicamente, a eletroterapia se desenvolveu antes mesmo da sua compreensão. William Harvey, por exemplo, reiniciou o coração de um pombo com um simples movimento do dedo em 1600. Em 1628 ele descreveu a circulação e, na década de 1640, publicações especulando sobre a natureza bioelétrica do sistema cardiovascular começaram a surgir. A primeira referência à estimulação elétrica externa do coração nos registros da Royal Human Society de Londres ocorreu em 1774 pelo médico Squires. Luigi Galvani, um médico italiano e cientista natural, anunciou em 1791 que a eletricidade era inerente ao tecido orgânico. Ele publicou as descobertas experimentais de fenômenos elétricos em corações de rãs, contribuindo fundamentalmente para a eletrofisiologia cardíaca moderna. Até que, pela primeira vez, o físico italiano Alessandro Volta demonstrou que a eletricidade poderia ser produzida por outros meios que não as máquinas eletrostáticas, e uma oportunidade para a experimentação clínica surgiu em 1882, com uma operária de 46 anos que se chamava Catharina Serafin, da Alta Silésia na Prússia. Um tumor de tórax foi removido junto com a parte anterior esquerda de sua parede torácica, o que expôs seu coração através de uma fina camada de pele. Von Ziemssen estimulou seu coração usando corrente elétrica e foi capaz de alterar a frequência cardíaca à vontade.²
Ademais, as primeiras aplicações bem-sucedidas da eletroterapia em pacientes com bradicardia envolveram geradores externos de pulso conectados à parede torácica ou diretamente ao coração por meio de fios.² Por razões óbvias, a mobilidade era limitada e os dispositivos eram desconfortáveis. Em 1958, o primeiro marca-passo totalmente implantável foi colocado por toracotomia aberta no Instituto Karolinska, na Suécia. O dispositivo, projetado por Rune Elmqvist e Ake Senning, tinha eletrodos epicárdicos que se conectavam diretamente ao coração. O marca-passo suportou o ritmo cardíaco do paciente por 3 horas e então teve que ser substituído por um novo dispositivo. Este paciente necessitou de um total de 26 trocas de marca-passo ao longo de sua vida, falecendo aos 86 anos de causa não relacionada. Nos Estados Unidos, marca-passos eletrônicos implantáveis projetados e construídos por Wilson Greatbatch, usando a tecnologia de bateria à base de mercúrio, foram introduzidos para uso humano na década de 1960. O primeiro paciente implantado com marca-passo Greatbatch viveu 18 meses.¹
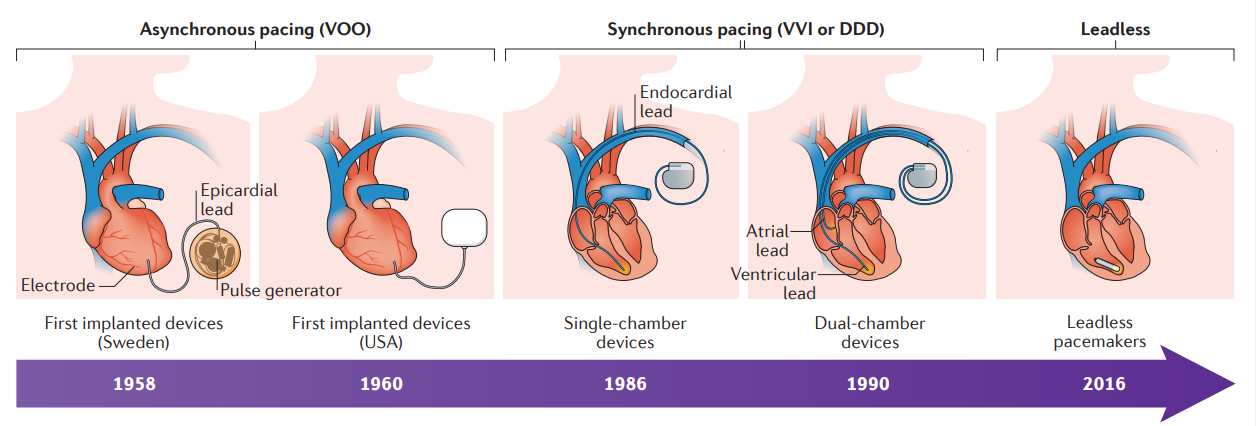
Desde os primeiros marca-passos eletrônicos implantáveis houve melhorias contínuas na tecnologia do dispositivo, com avanços no design do eletrodo, tamanho do gerador, longevidade da bateria e algoritmos de software que resultaram em dispositivos menores com funcionalidade aprimorada.
Uma das principais limitações dos primeiros dispositivos eletrônicos era a vida útil da bateria. Na tentativa de resolver esse problema, várias empresas desenvolveram marca-passos com energia nuclear. O primeiro deles, baseado em isótopos (238Pu), foi implantado em abril de 1970 na França. Esses dispositivos foram capazes de produzir estimulação estável por mais de 30 anos, mas fixa ou assíncrona, tornando-se síncrona apenas em gerações posteriores que permitiam a detecção do ritmo intrínseco do paciente e a estimulação somente sob demanda, quando nenhum ritmo intrínseco subjacente estava presente. Apesar de sua extraordinária longevidade, eles foram logo substituídos por dispositivos de última geração com tecnologia de bateria baseada em lítio. Dadas as óbvias preocupações de segurança dos dispositivos alimentados por isótopos, as baterias à base de lítio rapidamente se tornaram a fonte padrão de energia para marca-passos eletrônicos modernos.¹
Hoje, o marca-passo eletrônico típico consiste em um gerador subcutâneo e módulo de bateria conectado a um ou mais eletrodos endocárdicos. Dado o potencial de complicações relacionadas ao eletrodo, foram desenvolvidos marca-passos nos quais o gerador de pulso, a bateria e os eletrodos de detecção e estimulação são auto contidos em uma pequena cápsula projetada para ser distribuída no ventrículo direito. O marca-passo sem eletrodo, que é 90% menor do que um marca-passo transvenoso, é um gerador independente e um sistema de eletrodos implantado diretamente no ventrículo direito. O dispositivo é implantado por via transcateter da veia femoral e não requer incisão torácica ou bolso gerador subcutâneo. Ao eliminar o elo mais fraco do sistema (o eletrodo transvenoso), muitos riscos associados aos sistemas de estimulação convencionais são atenuados, como danos mecânicos diretos.¹
A cirurgia de implantação
A cirurgia para inserir um marca-passo cardíaco é um procedimento simples, na qual o médico insere o marca-passo percutaneamente, por via transvenosa, até o ventrículo direito, com o auxílio da fluoroscopia e de imagens contínuas de raios-X para guiar o procedimento. O mesmo também pode ser feito por técnica de visualização direta durante a cirurgia cardíaca. Esta abordagem híbrida não requer um segundo procedimento e atenua os riscos associados ao implante como lesão vascular e perfuração cardíaca. Nela, o eletrodo do marca-passo é conectado ao ápice ou septo do ventrículo direito diretamente após uma atriotomia direita e sob visualização direta usando cateter de entrega flexivel. As aletas da ponta do eletrodo do marca-passo permitem a sua fixação ativa no miocárdio. Na técnica de visualização direta, a função do marca-passo deve ser avaliada imediatamente após a circulação extracorpórea (CEC), no primeiro dia de pós-operatório e no seguimento ambulatorial de rotina, com um limiar de estimulação normal estabelecido para acompanhamento. Os pacientes são submetidos a ecocardiografia transtorácica bidimensional antes da alta.³
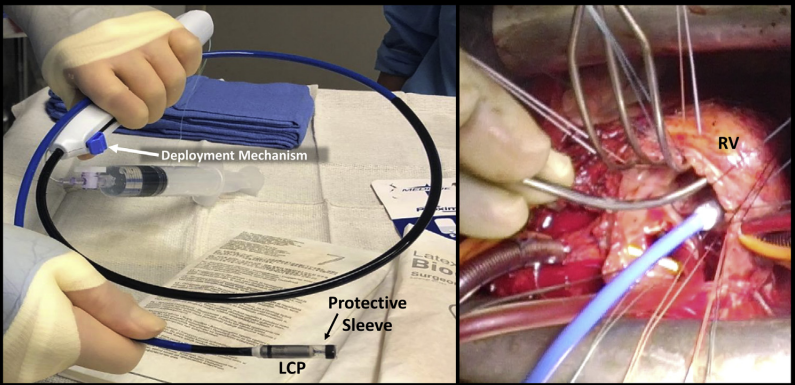
Ademais, normalmente o retorno à vida normal ocorre em poucos dias. Nas primeiras 8 semanas, é importante evitar movimentos bruscos que envolvam mover os braços bruscamente para longe do corpo e alguns ajustes permanentes incluem: evitar colocar pressão no marca-passo, conhecer os limites superior e inferior da frequência cardíaca, para garantir que ela permaneça dentro desses limites, permanecer fisicamente ativo, restringir o contato com dispositivos que podem interferir com o marca-passo, como telefones e micro-ondas e consultar um médico regularmente para seguimento.⁴
Nomenclatura dos marca-passos
Com o uso cada vez mais frequente de marca-passos cardíacos, fez-se necessário criar alguma forma de comunicar o papel exato deste dispositivo em seus portadores, de forma simples e acessível aos médicos assistentes. Foi pensando nisso que instituições como a North American Society of Pacing and Eletrophisiology (NASPE) e o British Pacing and Eletrophisiology Group (BPEG) criaram o código ICHD para nomenclatura internacional dos modos de estimulação artificial cardíaca.⁵

Embora as primeiras 3 letras sejam usadas com mais frequência, um código de 5 posições está em uso. A primeira posição indica a câmara estimulada; a segunda corresponde à câmara sentida/detectada; a terceira posição o modo de operação (o comportamento do aparelho frente a um sinal elétrico intrínseco do paciente); a quarta a capacidade de programabilidade e de resposta à frequência cardíaca; e a quinta posição denota a presença ou não de funções antitaquicardia.⁵
Um dispositivo, várias possibilidades
A programação do marca-passo pode ser realizada de forma não invasiva por um técnico em eletrofisiologia ou cardiologista. A maioria dos geradores de marca-passo tem um código de raio-X que pode ser visto em uma radiografia de tórax padrão. As marcações, junto com o formato do gerador, podem ajudar a decifrar o fabricante do gerador e da bateria do marca-passo. Existem muitas possibilidades de ajustes, combinando-se as diversas possibilidades de programação para cada função, mas existem algumas pré-configurações mais utilizadas rotineiramente.⁵
As configurações mais simples são VVI e AAT. O modo VVI detecta e estimula o ventrículo e é inibido por um evento ventricular detectado. Alternativamente, o modo AAT detecta e estimula o átrio, e cada evento detectado aciona o gerador para disparar dentro da onda P.⁶
Na configuração mais comum, o modo DDD, há detecção e estimulação atrioventricular, capaz tanto de deflagrar quanto inibir estímulos quando sente o batimento ventricular. É o modo de comando mais fisiológico por permitir mais autonomia dos ritmos próprios do paciente, quando presentes e dentro da normalidade. Isso requer dois eletrodos funcionando, um no átrio e outro no ventrículo, acoplados a um gerador de dupla câmara. No ECG, cada QRS é precedido por 2 picos, o primeiro indicando a despolarização atrial e o segundo indicando o início do complexo QRS. Visto que uma das derivações está no ventrículo direito, um padrão de bloqueio de ramo esquerdo pode ser evidente no ECG.⁵
O modo VDD é um tipo alternativo de estimulação de dupla câmara. Este tipo de estimulação cardíaca pode ser usado quando o nó sinusal está funcionando normalmente. Nesse caso, apenas um eletrodo é implantado, onde sua extremidade permanece na parede interna do ventrículo direito para estimular e sentir neste local. Esse mesmo eletrodo possui um pólo proximal que fica posicionado dentro do átrio direito e, nesse ponto, só consegue sentir os batimentos cardíacos.⁶
Cabe considerar que esse modo permite o implante em menor tempo, com menor uso de fluoroscopia e menos complicações em relação ao DDD, além de um custo menor. Contudo, é constatado que o implante de marca-passo VDD não é amplamente realizado na prática médica, apesar das vantagens citadas. Uma hipótese para tal é o medo da disfunção do nó sinusal, com aparecimento precoce de fibrilação atrial, e da diminuição de sensibilidade após o implante. Para contornar estas complicações, estudos afirmam que a avaliação cuidadosa da história clínica, eletrocardiograma e radiografias adequadas são suficientes para selecionar candidatos ao implante de marca-passo VDD e, portanto, raramente ocorre disfunção sinusal nessas condições. Logo, relatos na literatura de menor incidência de complicações, menor tempo de uso de fluoroscopia para implante, menor custo, sistema mais simples e de implantação mais fácil levam a crer que o marca-passo VDD continua sendo uma boa opção quando devidamente indicado, mediante seleção cuidadosa.¹
Desenvolvimento tecnológico
Pensando no futuro, sabe-se que a tecnologia do marca-passo eletrônico implantável continuamente evolui. Agora existe uma variedade de dispositivos tecnologicamente avançados, capazes de fornecer estimulação confiável para diferentes populações de pacientes. Algoritmos, por exemplo, que testam interativamente a saída mínima necessária (limiar de estimulação) para capturar o miocárdio (autocaptura), podem ajustar automaticamente a saída, aumentando a longevidade do marca-passo para mais de 10 anos. Além disso, algoritmos de software modernos podem monitorar a presença de condução nodal AV e minimizar a estimulação ventricular direita em pacientes com bloqueio nodal AV intermitente.¹
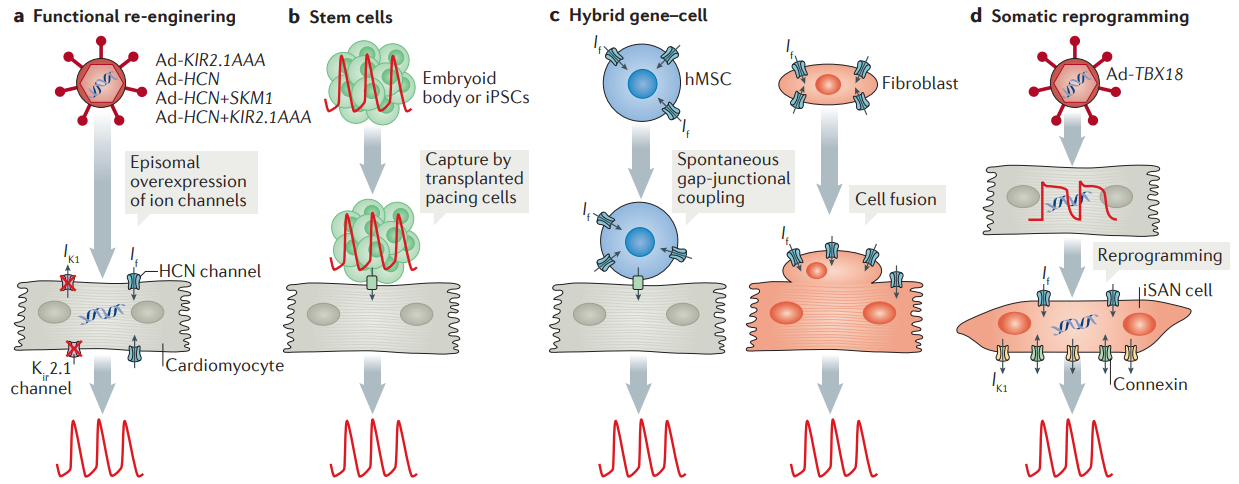
Adicionalmente, sabe-se que marca-passos biológicos, gerados por transferência de genes somáticos, fusão celular ou transplante de células, fornecem uma alternativa aos dispositivos eletrônicos. As estratégias de reprogramação somática, que envolvem a transferência de genes que codificam fatores de transcrição, para transformar o miocárdio ativo em um NSA substituto, estão mais adiantadas na tomada de decisões e seleção de tradução. Mesmo que os marca-passos eletrônicos se tornem menores e menos invasivos, os marca-passos biológicos podem expandir o arsenal terapêutico para distúrbios do sistema de condução.¹
Além disso, a estimulação biventricular sincronizada, obtida pela colocação de um eletrodo ventricular esquerdo através de um ramo venoso coronário, além de um eletrodo no ventrículo direito de forma convencional, provou prolongar a sobrevida e melhorar os sintomas e a fração de ejeção em pacientes com insuficiência cardíaca e complexos QRS alargados (correspondendo à despolarização ventricular) no eletrocardiograma. A implementação de marca-passos miniaturizados e sem fio foi demonstrada pela primeira vez em configurações suínas de peito aberto e fechado, na qual os desfechos clínicos associados a diferentes atrasos interventriculares foram verificados por meio de respostas eletrofisiológicas e hemodinâmicas. A estimulação de tórax fechado requer apenas a fonte de alimentação externa com consumo de energia de nível µW e um formato miniaturizado e flexível que é adequado para implantação epicárdica. A plataforma de estimulação sem bateria e sem eletrodo proposta mostra-se promissora no fornecimento de terapias avançadas em sincronização cardíaca.⁷
Na linha da experimentação clínica, sabe-se que animais pequenos suportam uma ampla gama de fenótipos e genótipos patológicos como modelos acessíveis para a patogênese de doenças cardiovasculares e para a exploração de estratégias em eletroterapia, terapia gênica e optogenética. A reexpressão de fatores de transcrição em cardiomiócitos ventriculares de camundongos, por exemplo, tem sido usada para transformar cardiomiócitos de câmara em células marca-passo, um achado base para uma estratégia de criação de marca-passos biológicos. Além disso, testes de estimulação multimodal in ex vivo e in vivo, ao longo de muitos dias, demonstram estabilidade crônica e excelente biocompatibilidade, com recursos para implantação subdérmica e tolerância de mais de 200.000 ciclos multiaxiais de tensão, sem degradação no desempenho elétrico ou óptico.⁸
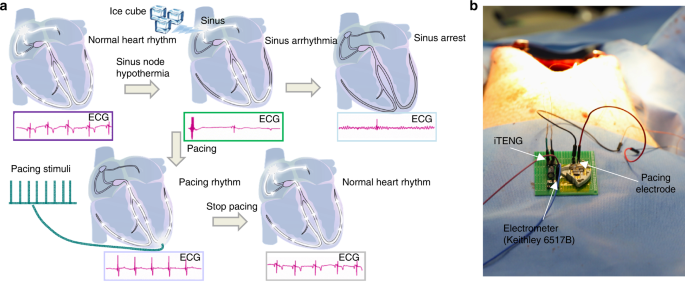
Por fim, dispositivos médicos eletrônicos implantáveis com alimentação própria, que coletam energia biomecânica do movimento cardíaco, do movimento respiratório e do fluxo sanguíneo, fazem parte de uma mudança de paradigma que está por vir. Um exemplo consiste em um marca-passo simbiótico totalmente implantado com base em um nanogerador triboelétrico implantável, que consegue coleta e armazenamento de energia, bem como estimulação cardíaca em uma escala de animais de grande porte. O marca-passo simbiótico corrige com sucesso a arritmia sinusal e evita a deterioração. A energia coletada de cada ciclo de movimento cardíaco é 0,495 μJ, que é maior do que a energia de limiar de estimulação endocárdica necessária (0,377 μJ).⁸
Riscos e complicações
Conforme já discutido, embora eficazes, os marca-passos com eletrodos envolvem riscos substanciais, com complicações geralmente relacionadas à inserção ou mau funcionamento do eletrodo e a infecções dos eletrodos ou geradores, causando endocardite bacteriana. Estas últimas podem ser fatais e requerem a remoção de todo o sistema, período durante o qual estratégias de estimulação temporárias são necessárias. Além disso, os eletrodos podem ser trombogênicos, criando trombose venosa profunda nos membros superiores, e podem afetar o movimento do folheto da válvula tricúspide, causando regurgitação tricúspide clinicamente significativa.¹
Para resolver essas complicações, bem como infecções associadas a geradores subcutâneos (extravasculares), os marca-passos sem eletrodos se mostram promissores. Contudo, essa tecnologia também apresenta limitações. As principais são a necessidade de um sistema introdutor venoso de grande calibre, a incerteza sobre os riscos infecciosos e trombogênicos e sua capacidade de fornecer apenas estimulação de câmara única, que impossibilitaria indicações comuns, como a doença do seio da face, onde a estimulação atrial é preferida, ou em condições em que a sincronia AV é desejada, como o ritmo sinusal com bloqueio AV crônico.⁸
Além disso, o implante de marca-passo em crianças apresenta desafios adicionais devido ao tamanho corporal menor, crescimento rápido e longa expectativa de vida, além das variações anatômicas associadas a defeitos cardíacos congênitos. Em geral, estimulação epicárdica (com eletrodos colocados por toracotomia) é recomendada para pacientes com peso corporal abaixo de 15kg ou anatomia desfavorável (por exemplo, presença de shunt intracardíaco ou ventrículo único). No entanto, os eletrodos de estimulação epicárdica são mais propensos a fraturas e frequentemente precisam ser substituídos por um novo eletrodo epicárdico ou por um sistema endocárdico, quando possível.⁸
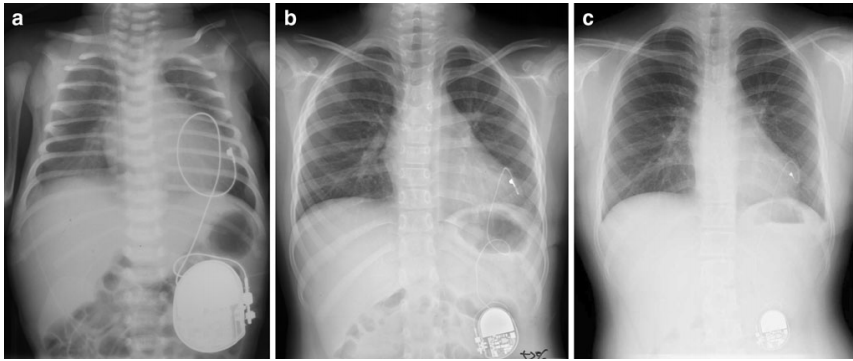
Embora marca-passos sem eletrodo tenham sido usados em pacientes a fim de evitar infecções relacionadas, o risco de “propagação” bacterêmica do dispositivo sem eletrodo ainda precisa ser estudado em longo prazo. E, mesmo que os fabricantes tenham desenvolvido diferentes sistemas de detecção e algoritmos de software, os marca-passos da geração atual não têm capacidade de resposta autonômica verdadeira para prover as necessidades fisiológicas.¹
Portanto, com os avanços contínuos em sensores e tecnologias vestíveis, os marca-passos de última geração provavelmente combinarão diferentes sistemas de detecção (ou seja, acelerômetro, impedância, débito cardíaco e pressão arterial) e algoritmos de software complexos para oferecer suporte com mais precisão às necessidades fisiológicas. Tudo isso no sentido de imitar, pelo menos parcialmente, esse grande maestro que dita o ritmo da vida: o coração.
REFERÊNCIAS
¹ Cingolani E, Goldhaber JI, Marbán E. Next-generation pacemakers: from small devices to biological pacemakers. 2017. [Acesso em: 20 abr. 2021]. Disponível em: https://www.nature.com/articles/nrcardio.2017.165
² Aquilina O. A brief history of cardiac pacing. 2006. [Acesso em: 20 abr. 2021]. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3232561/
³ Shivamurthy P et al. Leadless pacemaker implantation under direct visualization during valve surgery [internet]. 2020. [Acesso em: 20 abr. 2021]. Disponível em: https://www.jtcvs.org/article/S0022-5223(20)32264-9/abstract
⁴ A Kandola, Whitworth G. What to know about heart pacemakers [internet]. 2019. [Acesso em: 20 abr. 2021]. Disponível em: https://www.medicalnewstoday.com/articles/324662 TVs nativas e bioprotéticas
⁵ Saraon TS et al. Pacemaker and Automatic Internal Cardiac Defibrillator [internet]. 2009. [Acesso em: 20 abr. 2021]. Disponível em: https://www.researchgate.net/publication/315763692_Pacemaker_and_Automatic_Internal_Cardiac_Defibrillator
⁶ Galbas MC. Como interpretar a nomenclatura dos marca-passos cardíacos [internet]. 2019. [Acesso em: 20 abr. 2021]. Disponível em: https://pebmed.com.br/como-interpretar-a-nomenclatura-dos-marcapassos-cardiacos/
⁷ Lyu H et al. Synchronized Biventricular Heart Pacing in a Closed-chest Porcine Model based on Wirelessly Powered Leadless Pacemakers [internet]. 2020. [Acesso em: 20 abr. 2021]. Disponível em: https://www.nature.com/articles/s41598-020-59017-z
⁸ Gutruf P et al. Wireless, battery-free, fully implantable multimodal and multisite pacemakers for applications in small animal models [internet]. 2019. [Acesso em: 20 abr. 2021]. Disponível em: https://www.nature.com/articles/s41467-019-13637-w
⁹ Takeuchi D, Tomizawa Y. Pacing device therapy in infants and children: a review [internet]. 2012. [Acesso em: 20 abr. 2021]. Disponível em: https://pubmed.ncbi.nlm.nih.gov/23104398/
25