A cirurgia cardíaca representa a perfeita união entre maestria cirúrgica e tecnologia. Para operar um coração, é comum que sua função, assim como a dos pulmões, seja temporariamente assumida pela máquina de circulação extracorpórea (CEC), enquanto o cirurgião realiza reparos estruturais ou funcionais, proporcionando ao paciente a chance de acréscimo em anos de vida. No entanto, para que esse objetivo seja alcançado, é fundamental que não apenas o intraoperatório, mas também todo o acompanhamento perioperatório, siga as mais recentes diretrizes baseadas em evidências, considerando as particularidades clínicas e as necessidades específicas de cada paciente, para garantir uma recuperação segura e otimizada.
Os cuidados pós-operatórios começam com a transição do paciente da equipe cirúrgica e anestésica para a equipe de cuidados intensivos. Essa passagem de caso deve ser formal e protocolizada, garantindo que nenhuma informação essencial seja omitida. No entanto, mais do que um procedimento protocolar, trata-se de uma comunicação clara e precisa, cuja efetividade influencia diretamente os desfechos clínicos. Uma transição bem conduzida reflete a integração entre as equipes e o compromisso com a continuidade do cuidado[1]. Vejamos o que disse Antoine de Saint-Exupéry, autor de O pequeno príncipe, sobre o trabalho em equipe: “Se você quer construir um navio, não chame as pessoas para juntar madeira ou atribua-lhes tarefas e trabalho, mas sim ensine-os a desejar a infinita imensidão do oceano”.
Nessa frase, o autor deixa uma lição muito clara: um trabalho em equipe verdadeiramente eficaz não se baseia apenas na distribuição de funções, mas na construção de um propósito compartilhado. Da mesma forma, a passagem de caso no pós-operatório não deve se restringir a um relato técnico sobre o tempo de CEC ou a quantidade de bolsas de concentrado de hemácias transfundidas. Mais do que a simples anotação desses dados pela equipe da Unidade de Terapia Intensiva (UTI), a comunicação deve abranger a “infinita imensidão” das singularidades de cada paciente e de sua condição clínica. Somente assim é possível definir metas terapêuticas precisas e garantir uma recuperação cirúrgica otimizada.
Desde 2001, equipes cirúrgicas de diversas especialidades têm desenvolvido e aprimorado os protocolos ERAS (Enhanced Recovery After Surgery), com o principal objetivo de otimizar os resultados cirúrgicos por meio da implementação da medicina baseada em evidências e das melhores práticas. Na cirurgia cardíaca, esse movimento ganhou força em 2017, com a realização do simpósio inaugural Enhanced Recovery After Cardiac Surgery (ERACS) em Boston, Massachusetts[2].Em 2019, a ERAS Society apresentou diretrizes com recomendações baseadas em evidências, abrangendo aspectos do cuidado perioperatório que podem ser incorporados a protocolos ERAS institucionais[3].
Os cuidados pós-operatórios em cirurgia cardíaca sempre foram fundamentados em evidências, abrangendo desde a otimização hemodinâmica até a ventilação protetora. Embora apenas recentemente um protocolo ERAS específico para a especialidade tenha sido formalmente proposto, sua aplicação já foi testada em estudos que demonstraram benefícios significativos, como a redução do tempo de internação e a menor incidência de complicações, incluindo acidente vascular cerebral. Esses resultados são atribuídos, principalmente, à terapia de fluidos orientada por metas e à analgesia multimodal poupadora de opioides[4]. Além disso, o protocolo enfatiza a extubação precoce, a remoção antecipada de drenos torácicos e cateter urinário, a mobilização precoce e estratégias para prevenir a fibrilação atrial.
Além desses aspectos, também serão discutidos temas como reaquecimento, antibioticoterapia profilática e prevenção de lesão aguda da mucosa gastrointestinal (LAMG) e de tromboembolismo venoso (TEV).
É importante destacar que o protocolo ERACS, assim como outras diretrizes voltadas para a otimização da recuperação cirúrgica, geralmente abrangem todo o período perioperatório. Neste texto, porém, o foco será o manejo pós-operatório, com recomendações baseadas no protocolo ERACS, em revisões de literatura e em livro-texto de medicina intensiva[1-3,5,6].
Manejo hemodinâmico
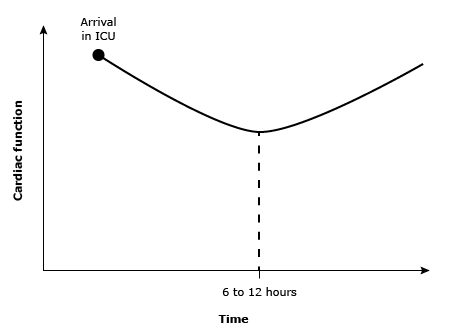
O manejo hemodinâmico no pós-operatório de cirurgia cardíaca em UTI envolve três variáveis fundamentais: pré-carga, inotropismo e pós-carga. A pré-carga pode ser afetada tanto por hipovolemia quanto por hipervolemia, ambas de origem multifatorial. Na hipervolemia, destaca-se a influência do volume de prime administrado no início da CEC, enquanto a hipovolemia pode resultar de sangramento, extravasamento capilar ou vasodilatação, levando a uma hipovolemia relativa. O inotropismo sofre impacto em decorrência de lesão dos cardiomiócitos durante o período de isquemia, agravada pelo fenômeno de isquemia-reperfusão. A função miocárdica geralmente segue um padrão de curva com concavidade voltada para cima, atingindo seu ponto mais crítico cerca de seis horas após a cirurgia (Figura 1), exigindo atenção redobrada do intensivista para a identificação precoce de sinais de choque cardiogênico. Já a pós-carga pode sofrer variações significativas, e o aumento da resistência vascular periférica (RVP) pode reduzir o índice cardíaco e agravar a deterioração clínica, especialmente em pacientes com disfunção miocárdica. Por outro lado, a diminuição da RVP geralmente ocorre em virtude da vasoplegia resultante da resposta inflamatória provocada pelo contato do sangue com os componentes da CEC[1].
A avaliação hemodinâmica combina parâmetros clínicos, laboratoriais e de monitorização avançada. Entre os parâmetros clínicos, destacam-se nível de consciência, tempo de enchimento capilar, diurese e presença de livedo. Os laboratoriais incluem lactato, excesso de bases, saturação venosa central ou mista de O₂, gap arteriovenoso de CO₂ e níveis de hemoglobina. Já os hemodinâmicos englobam a pressão arterial invasiva, com meta de pressão arterial média entre 60 e 90 mmHg na maioria dos casos, frequência cardíaca e estimativas de débito cardíaco, utilizando cálculos do volume de integral de velocidade (VTI), resposta à expansão volêmica (p. ex., com a avaliação da variação do volume sistólico), pressões de enchimento e avaliação da função ventricular e valvar por ecocardiografia transtorácica (ECOTT) à beira-leito. O cateter de Swan-Ganz não é utilizado rotineiramente, sendo indicado apenas em situações específicas, como em pacientes com disfunção de ventrículo direito e hipertensão pulmonar associadas à disfunção grave de ventrículo esquerdo[1,6].
O tratamento inicial da hipotensão inclui expansão volêmica com soluções cristaloides, avaliando-se a fluidorresponsividade. Nos casos refratários, considera-se a introdução de vasopressores, como noradrenalina, associando-se vasopressina em doses elevadas de noradrenalina (≥ 0,25-0,5 mcg/kg/min) para manter a estabilidade hemodinâmica. Em casos de choque vasoplégico refratário, o uso de azul de metileno e hidrocortisona pode ser indicado. Já no choque cardiogênico, a abordagem inclui inotrópicos, dispositivos de assistência ventricular e vasodilatadores, conforme o contexto, além de outras terapias de suporte. Outras causas de choque, como tamponamento cardíaco, pneumotórax, disfunção valvar e isquemia, sempre devem ser descartadas para garantir um tratamento eficaz[1].
O objetivo principal é assegurar um suprimento adequado de oxigênio para as células e tecidos (DO₂), que depende do débito cardíaco (DC) e do conteúdo arterial de oxigênio (CaO₂), conforme a equação: DO₂ (mL/min) = DC (L/min) × CaO₂ (mL/dL) × 10 (ajuste de unidades). O DC é influenciado pela frequência cardíaca e pelo volume sistólico, enquanto o CaO₂ é determinado pela concentração de hemoglobina, saturação de oxi-hemoglobina arterial e pressão parcial de oxigênio no sangue arterial. O intensivista deve se concentrar no ajuste dessas variáveis para otimizar o manejo hemodinâmico do paciente[6].
Suporte ventilatório
Em virtude da sobrecarga hídrica e da resposta inflamatória induzida pela CEC, a cirurgia cardíaca favorece o desenvolvimento de edema pulmonar no pós-operatório, além de atelectasias, que podem estar relacionadas, entre outros fatores, à ventilação periódica e à lesão do nervo frênico. O principal objetivo do manejo na UTI é a extubação precoce, idealmente entre 4 e 6 horas após a admissão, para os pacientes elegíveis, garantindo ventilação protetora desde o intraoperatório até a extubação. Essa abordagem reduz a incidência de complicações pulmonares, a necessidade de sedoanalgesia, acelera a recuperação, facilita a mobilização precoce e contribui para a redução dos custos e do tempo de internação hospitalar[3].
Pacientes clínica e hemodinamicamente estáveis, que atendem a critérios específicos, como gasometria arterial adequada e débito satisfatório dos drenos, podem ser submetidos a um teste de respiração espontânea em ventilação com pressão de suporte (PSV) por 30 minutos. Em caso de sucesso, a extubação é realizada. Para aqueles com risco de falha na extubação, o uso de cateter nasal de alto fluxo pode ser uma estratégia benéfica no período pós-extubação[1].
Sedação e analgesia
A minimização da sedação e do uso de opioides é um princípio fundamental no manejo da sedoanalgesia em pacientes cirúrgicos. No entanto, enquanto o uso excessivo de opioides está associado a efeitos adversos, como depressão respiratória, náuseas, vômitos e íleo, o controle inadequado da dor pode resultar em complicações pulmonares decorrentes da imobilização respiratória, além de complicações cardiovasculares secundárias à ativação simpática, aumentando a demanda de oxigênio pelo miocárdio e predispondo a arritmias. Além disso, a dor mal controlada eleva o risco de delirium e de dor pós-operatória persistente[6].
Nesse contexto, a abordagem multimodal torna-se a pedra angular no tratamento da dor pós-operatória, pois assegura analgesia adequada ao mesmo tempo que evita o uso excessivo de opioides e sedativos. Essa estratégia inclui analgésicos simples, como paracetamol – mais utilizado nos Estados Unidos – e/ou dipirona, além de cetamina e dexmedetomidina intravenosas, em combinação com bloqueios locorregionais, reservando o uso de opioides fortes para casos de dor refratária[6].
O despertar e a extubação precoces devem ser priorizados, mas, em pacientes mais graves ou com risco de deterioração clínica progressiva, essas estratégias requerem cautela, com uma abordagem individualizada e ajustada à evolução clínica de cada paciente. Além disso, o uso de benzodiazepínicos no pós-operatório de cirurgia cardíaca de rotina deve ser evitado, pois está associado a um maior risco de delirium, especialmente quando utilizados em infusão contínua, além de prolongar a ventilação mecânica e o tempo de internação na UTI[3].
Profilaxia e tratamento das arritmias
As arritmias mais comuns no pós-operatório são as supraventriculares, com destaque para o flutter e a fibrilação atrial, frequentemente decorrentes de traumas diretos ao sistema de condução durante a cirurgia, especialmente em procedimentos valvares. Essas arritmias aumentam o risco de eventos cardioembólicos e reduzem o índice cardíaco, sobretudo em pacientes com disfunção ventricular. A primeira linha de profilaxia é o uso de betabloqueadores, desde que o paciente não esteja em uso de inotrópicos, vasopressores ou não apresente disfunção significativa do ventrículo esquerdo. Caso contrário, a amiodarona é a opção preferida. Já as arritmias ventriculares são menos comuns e devem levantar a suspeita de lesão coronariana[1].
Além disso, pacientes no pós-operatório também estão sob risco de desenvolver bradiarritmias, que podem variar de bradicardia sinusal a bloqueio atrioventricular total. Essas alterações geralmente resultam de traumas diretos ao sistema de condução durante a cirurgia ou do uso de antiarrítmicos. Para o manejo dessas complicações, eletrodos de marca-passo epicárdico podem ser posicionados no ventrículo durante o procedimento, com ou sem eletrodos atriais, permitindo estimulação artificial imediata em caso de bradicardia com repercussão hemodinâmica. Nos pacientes que não toleram o desmame da estimulação artificial, o implante de marca-passo definitivo deve ser considerado[1].
Reaquecimento
A hipotermia é uma condição frequente em pacientes submetidos a cirurgia cardíaca, podendo ocorrer de forma intencional, como na hipotermia profunda utilizada em cirurgias de arco aórtico, ou de maneira inadvertida, associada a irrigação pericárdica, perda de calor pela exposição de cavidades abertas e administração de fluidos em temperatura ambiente. Como parte da tríade letal do choque (hipotermia, acidose e coagulopatia), essa condição pode causar arritmias, disfunção miocárdica e atraso no desmame da ventilação mecânica. Por isso, seu controle deve ser priorizado, mantendo a temperatura central entre 36 e 37 °C, com o auxílio de mantas de ar aquecido, aumentando a temperatura ambiente do quarto e aquecendo fluidos intravenosos[1].
Manejo de drenos
O monitoramento rigoroso do débito do dreno mediastinal é essencial, mas a “ordenha de rotina não é recomendada. O sangramento pós-operatório é esperado e volumes excessivos exigem comunicação imediata com a equipe cirúrgica e avaliação de coagulopatia para evitar atrasos na reabordagem. Pacientes com alto débito devem ter o dreno em aspiração contínua para prevenir coágulos e tamponamento cardíaco. A hemostasia é otimizada com a correção de distúrbios como heparinização residual, hipocalcemia, hipotermia e acidose, mantendo a PA sistólica < 100 mmHg e evitando hemodiluição. Apesar da ausência de critérios padronizados para a remoção do dreno mediastinal, as evidências indicam que sua retirada é segura quando a drenagem se apresenta macroscopicamente serosa[1,3].
Antibioticoterapia profilática
A profilaxia antibiótica é iniciada no intraoperatório, idealmente dentro de 60 minutos antes da incisão cirúrgica, sendo comumente realizada com cefazolina ou cefuroxima. Nos casos em que há risco de colonização por Staphylococcus aureus resistente à meticilina, a vancomicina deve ser priorizada, com infusão iniciada pelo menos duas horas antes da cirurgia. O regime profilático deve ser mantido por, no mínimo, 24 horas, e o intensivista deve estar atento ao fato de que prolongar a profilaxia além de 48 horas não oferece benefícios adicionais[1].
Profilaxia de lesão aguda da mucosa gastrointestinal, tromboembolismo venoso e controle glicêmico
Pacientes no pós-operatório de cirurgia cardíaca devem receber profilaxia para LAMG com inibidores da bomba de prótons, pelo maior risco de hemorragia digestiva associada ao uso de antiplaquetários e anticoagulantes. Na ausência de sangramentos ativos, a profilaxia para TEV pode ser iniciada dentro das primeiras 24 horas[6].
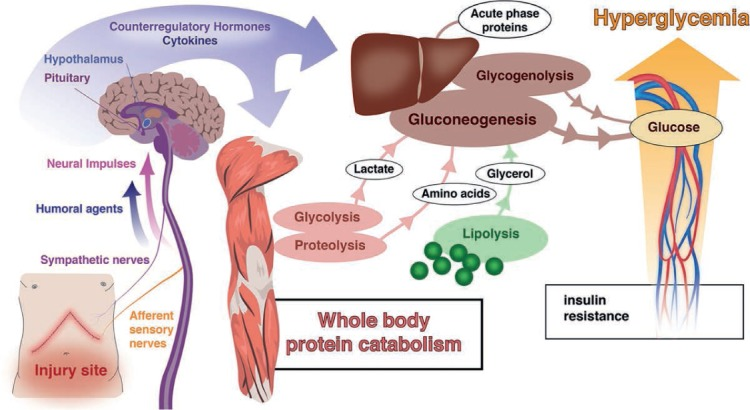
Mesmo em pacientes não diabéticos, a hiperglicemia é frequente no pós-operatório, resultante do aumento dos hormônios contrarregulatórios induzido pelo estresse cirúrgico (Figura 2). O controle glicêmico deve priorizar a administração de insulina para um alvo de glicemia ≤ 180 mg/dL[1,2].
Outras questões importantes e considerações finais
A alimentação oral é iniciada na UTI logo após a extubação traqueal, seguindo as diretrizes de nutrição precoce em cirurgias de grande porte. Caso o paciente não consiga ingerir ao menos 80% das calorias necessárias até o segundo ou terceiro dia, inicia-se suporte nutricional enteral por sonda nasoenteral. Além disso, a triagem para delirium pós-operatório é realizada rotineiramente após cirurgia cardíaca, especialmente em pacientes com fatores de risco como idade avançada, fragilidade e apneia obstrutiva do sono[6].
Em conclusão, o principal objetivo do manejo pós-operatório na UTI em cirurgia cardíaca é garantir a estabilidade clínica do paciente com mínima necessidade de suporte, possibilitando sua transferência para uma unidade de menor complexidade. Para isso, é essencial que a dor e o delirium estejam controlados, os monitoramentos invasivos tenham sido removidos, a pressão arterial e arritmias estejam estabilizadas, a função pulmonar esteja preservada com pouca ou nenhuma necessidade de oxigênio suplementar, a nutrição enteral seja tolerada, o débito urinário permaneça acima de 0,5 mL/kg e os drenos tenham sido retirados. Dessa forma, busca-se garantir que, nos dias seguintes, suas funções orgânicas evoluam adequadamente, permitindo o retorno progressivo às atividades diárias e à qualidade de vida.
Para uma leitura mais aprofundada sobre o assunto, consulte as referências 7 a 11.
Referências
- Azevedo LCP Taniguchi LU, Ladeira JP, Martins HS, Velasco IT Medicina intensiva: abordagem prática. Barueri: Manole; 2018.
- Brown JK, Singh K, Dumitru R, Chan E, Kim MP. The benefits of Enhanced Recovery After Surgery Programs and their application in cardiothoracic surgery. Methodist Debakey Cardiovasc J. 2018;14(2):77-88.
- Engelman DT, Ben Ali W, Williams JB, Perrault LP, Reddy VS, Arora RC, et al. Guidelines for perioperative care in cardiac surgery: Enhanced Recovery After Surgery Society Recommendations. JAMA Surg. 2019;154(8):755-66.
- Spadaccio C, Salsano A, Pisani A, Nenna A, Nappi F, Osho A, et al. Enhanced recovery protocols after surgery: A systematic review and meta-analysis of randomized trials in cardiac surgery. World J Surg. 2024; 48:779.
- Noss C, Prusinkiewicz C, Nelson G, Patel PA, Augoustides JG, Gregory AJ. Enhanced Recovery for Cardiac Surgery. J Cardiothorac Vasc Anesth. 2018;32(6):2760-70.
- Barbeito A, Dolinski SY, Lemm J. Postoperative care after cardiac surgery [Internet]. UpToDate. 2025 [citado 13 fev. 2025]. Disponível em: www.uptodate.com.
- Wong WT, Lai VK, Chee YE, Lee A. Fast-track cardiac care for adult cardiac surgical patients. Cochrane Database Syst Rev. 2016;9:CD003587.
- Chakravarthy M. Regional analgesia in cardiothoracic surgery: A changing paradigm toward opioid-free anesthesia? Ann Card Anaesth. 2018;21:225.
- Markham T, Wegner R, Hernandez N, Lee JW, Choi W, et al. Assessment of a multimodal analgesia protocol to allow the implementation of enhanced recovery after cardiac surgery: Retrospective analysis of patient outcomes. J Clin Anesth. 2019;54:76.
- Wu M, Liang Y, Dai Z, Wang S. Perioperative dexmedetomidine reduces delirium after cardiac surgery: A meta-analysis of randomized controlled trials. J Clin Anesth. 2018;50:33.
- Grant MC, Isada T, Ruzankin P, Gottschalk A, Whitman G, et al. Opioid-Sparing Cardiac Anesthesia: Secondary Analysis of an Enhanced Recovery Program for Cardiac Surgery. Anesth Analg. 2020;131:1852.